
【题目】人体细胞鲜重中含量最多的元素和组成生物体的最基本元素,分别是( )
A.C、OB.H、CC.O、CD.O、N
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4SO3)、硫代硫酸(H2S2O3)等等,其中硫酸最为重要,在工业上有广泛的应用.在实验室,浓硫酸是常用的干燥剂.完成下列计算:
(1)焦硫酸(H2SO4 . SO3)溶于水,其中的SO3都转化为硫酸.若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为mol/L.
(2)若以浓硫酸吸水后生成H2SO4 . H2O计算,250g质量分数为98%的硫酸能吸收多少g水?
(3)硫铁矿是工业上制硫酸的主要原料.硫铁矿氧化焙烧的化学反应如下:3FeS2+8O2→Fe3O4+6SO2 4FeS2+11O2→2Fe2O3+8SO2
若48molFeS2完全反应耗用氧气2934.4L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量之比.
(4)用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸的方法.硫化氢体积分数为0.84的混合气体(H2S、H2O、N2)在空气中完全燃烧,若空气过量77%,计算产物气体中SO2体积分数(水是气体).
已知空气组成:N2体积分数0.79、O2体积分数0.21.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一瓶混有少量NaCl杂质的NaOH固体试剂,为准确测其纯度,采用盐酸滴定法进行测定.
①称取Wg NaOH固体试剂配制成100.00mL水溶液备用;
②将浓度为 c mol/L的标准盐酸装在用标准盐酸润洗过的25.00mL酸式滴定管中,调节液面位置在零刻度以下,并记下刻度;
③取V1mL NaOH待测溶液置于洁净的锥形瓶中,加入2~3滴甲基橙指示剂充分振荡,然后用浓度为c mol/L的标准盐酸滴定,重复测定3次,平均用去盐酸V2mL.
试回答:
(1)配制标准盐酸溶液时,必须使用的最主要玻璃仪器是 .
(2)滴定时,滴定过程中两眼应该注视 . 滴定终点时溶液颜色由色突变为色.在盛放待测溶液的锥形瓶下方放一张白纸的作用是 .
(3)下列操作会使实验测得结果偏大的是(填选项的序号);
A.用湿润的pH试纸测定某NaOH溶液的pH
B.中和滴定实验中用蒸馏水洗净的锥形瓶直接装待测液
C.若滴定前酸式滴定管尖嘴气泡未排出,滴定结束后气泡消失
D.装标准盐酸的酸式滴定管没有进行润洗
E.读数时,若滴定前仰视,滴定后俯视
(4)固体试剂NaOH的质量分数的表达式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A~G有如图所示的转化关系(部分生成物已略去),其中A、G为单质,D是能使湿润的红色石蕊试纸变蓝色的气体,E、F均能与NaOH溶液反应.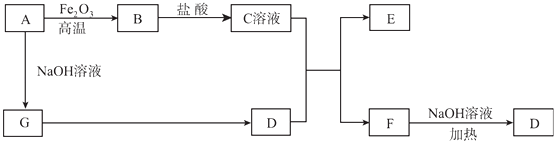
请回答下列问题:
(1)写出F的电子式:;
(2)①C溶液与D的水溶液反应的离子方程式为;②F溶液与NaOH溶液共热反应的化学方程式为;
(3)①请用离子方程式解释C溶液为何显酸性;②F溶液中离子浓度由大到小的顺序为;
(4)将5.4 g A投入到200 mL 2.0 mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是(填代号);
A.HNO3溶液
B.H2SO4溶液
C.NaOH溶液
D.HCl溶液
(5)将1mol N2和3mol G及催化剂充入容积为2 L的某密闭容器中进行反应,已知该反应为放热反应.平衡时,测得D的物质的量浓度为a mol/L.在其他条件不变的情况下,若起始时充入0.5 mol N2和1.5mol G达到平衡后,D的物质的量浓度(填“大于”“小于”或“等于”)a/2mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别向盛有淀粉—碘溶液的两烧杯中滴加新鲜黄瓜汁和久置黄瓜汁,黄瓜汁中含有的维生素C能使淀粉—碘溶液褪色,实验结果见下表。下列说法不正确的是( )
黄瓜汁 | 新鲜 | 久置 |
滴数 | 12 | 20 |
A.维生素C具有还原性,能将碘单质还原为I-
B.实验时两烧杯中的淀粉—碘溶液的浓度和体积相等
C.新鲜黄瓜汁中比久置黄瓜汁中维生素C含量低
D.维生素C缺乏的病人要多吃新鲜的蔬菜和水果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,将充满NO2的试管倒扣到盛水的水槽中,一段时间后,试管内气体的体积是试管体积的________________,假设试管内溶质不扩散,则试管内溶液中溶质的物质的量浓度为___________________。
(2)某铁的“氧化物”样品,用5mol/L的盐酸100mL恰好完全溶解,所得溶液还能吸收标准状况下1.12L氯气,使其中Fe2+恰好全部转化为Fe3+,发生反应的离子方程式为_________,该样品中Fe和O的个数比为_______________。
(3)向盛有10mL1mol/LNH4Al(SO4)2溶液的烧杯中滴加1mol/LNaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:(已知NH4++OH-=NH3·H2O)
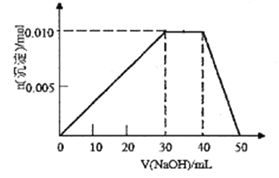
①写出滴加NaOH溶液40~50mL时反应的离子方程式:__________________。
②若10mL1mol/LNH4Al(SO4)2溶液中改加20mL1.15mol/LBa(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_________________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】比较小麦和家兔体内的各种化学元素( )
A.种类和含量都相差很大
B.种差相差很大,其中相同元素的含量都大体相同
C.种类和含量都相差不大
D.种类大体相同,其中相同元素的含量大都相差很大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用20 mL 18.4 mol/L浓H2SO4和铜共热一段时间后,使反应混合物冷却,滤去多余的铜,将滤液加水定容到100 mL,测得SO42-离子物质的量浓度为3. 18 mol/L。试求溶液中CuSO4的物质的量浓度( )
A. 0.50 mol/L B. 0.75 mol/L C. 1.00 mol/L D. 3.18 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A.1 L0.6molL﹣1的食盐水中含氯化钠0.6mol
B.0.5mol碳酸钠溶于水配成0.5L溶液,所得溶液的物质的量浓度为0.5molL﹣1
C.标准状况下,44.8L氯化氢气体溶于1L水中所得溶液的物质的量浓度为2molL﹣1
D.20g氢氧化钠溶于水配成物质的量浓度为1molL﹣1的溶液,可得溶液1L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com