
【题目】最近,我国某物理研究所取得重大科技成果,研制出由18O所形成的单质气体。18O是一种稳定的同位素,称为重氧。下列有关说法不正确的是( )
A.1.8 g18O形成的气体的物质的量是0.05 mol
B.0.1 mol重氧水H218O所含的中子数约为6.02×l023个
C.0.2 mol18O2气体的体积约为4.48 L
D.18O2气体的摩尔质量为36 g/mol
 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. NH3和CH4的中心原子都是sp3杂化
B. 基态原子的核外电子排布为[Kr]4d105s1的元素属于d区
C. SO2和CO2都是直线形分子,其中心原子都是sp杂化
D. 电子由低能级跃迁至较高能级时,可通过光谱仪直接摄取原子的发射光谱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图像如图所示,下列说法正确的是
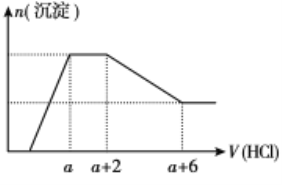
A. 原溶液中一定含有Na2SO4
B. 反应后最终溶液中的溶质只有AlCl3
C. 原溶液中含有CO32-与AlO2-的物质的量之比为1:1
D. 原溶液中一定含有的阴离子是OH-、SiO32-、AlO2-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是

A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.一氧化碳的摩尔质量与6.02×1023个氮气分子的质量在数值上相等
B.6.02×1023个N2和6.02×1023个O2的质量比等于7︰8
C.3.2gO2所含的原子数目约为0.2×6.02×1023
D.常温、常压下,0.5×6.02×1023个二氧化碳分子质量是44g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A.相同条件下,质量相等的CO和CO2它们所含的氧原子数目之比为11:7
B.同体积、同密度的C2H4和CO,两种气体的分子数一定相等
C.配制450mL0.1molL-1的NaOH溶液,用托盘天平称取NaOH固体1.8g
D.1L0.45molL-1NaCl溶液中Cl-的物质的量浓度比0.1L0.1 molL-1AlCl3溶液大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列相关化学用语表述正确的是( )
A. NH4Cl的电子式: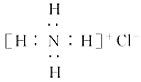
B. C原子的轨道表示式: ![]()
C. 冰醋酸为共价化合物,受热熔融:CH3COOH![]() CH3COO-+H+
CH3COO-+H+
D. Fe2+基态核外电子排布式为1s22s22p63s23p63d6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,2.24 L乙醇中含有的氧原子数目为0.1NA
B.1 L 1mol/L的NaHCO3溶液中Na+、H+和CO32-的数目均为NA
C.16 g的O2和O3混合气体中所含原子总数为NA
D.18 g水中所含电子总数为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水氯化锌常用作有机合成的催化剂。实验室采用HCl气体除水、ZnCl2升华相结合的方法提纯市售氯化锌样品(部分潮解并含高纯高温不分解杂质)。实验装置如图所示:
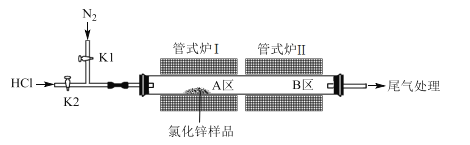
回答下列问题:
(1)无水氯化锌在空气中易潮解生成Zn(OH)Cl的化学方程式为_____。
(2)除水阶段:打开K1,K2。将管式炉I、II升温至150 ℃,反应一段时间后将管式炉I、II的温度升至350 ℃,保证将水除尽。除水阶段发生反应的化学方程式为 ____。
(3)升华阶段:撤去管式炉II,将管式炉I迅速升温至750℃,升温的目的是_____。一段时间后关闭管式炉I并关闭 ____(填K1或K2),待冷却后关闭 ____(填K1或K2)。最后将_____(填A或B)区的氯化锌转移、保存。
(4)除水阶段HCl与 N2流速要快,有利于提高除水效率。升华阶段HCl与N2流速要慢,其原因是_____。
(5)测定市售ZnCl2样品中的锌的质量分数。步骤如下:
① 溶液配制:称取m g样品,加水和盐酸至样品溶解,转移至250 mL的 ____中,加蒸馏水至刻度线,摇匀。
② 滴定:取25.00mL待测液于锥形瓶中,用c mol·L-1K4[Fe(CN)6]标准溶液滴定至终点,消耗V mL。滴定反应为:2K4[Fe(CN)6]+3ZnCl2=K2Zn3[Fe(CN)6]2↓+6KCl该样品中锌的质量分数为 ____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com