
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| D. | CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y) kJ•mol-1 |
分析 根据题意可知,22gCO2通入1mol•L-1NaOH溶液750mL中充分反应,测得反应放出xkJ的热量,写出热化学反应方程式,再利用1mol CO2通入2mol•L-1NaOH溶液1L中充分反应放出y kJ的热量写出热化学反应方程式,最后利用盖斯定律来书写CO2与NaOH溶液反应生成NaHCO3的热化学方程式.
解答 解:根据题意,22gCO2通入1mol•L-1NaOH溶液750mL中充分反应,n(CO2)=$\frac{22g}{44g/mol}$=0.5mol,n(NaOH)=1mol•L-1×0.75L=0.75mol,
该反应既生成碳酸钠又生成碳酸氢钠,方程式为2CO2+3NaOH═NaHCO3+Na2CO3+H2O,
由0.5molCO2反应放出热量为xKJ,则2molCO2反应放出热量为4xKJ,即热化学反应方程式为
2CO2(g)+3NaOH(aq)═NaHCO3 (aq)+Na2CO3(aq)+H2O(l)△H=-4xKJ/mol①,
又1mol CO2通入2mol•L-1NaOH溶液1L中充分反应放出y kJ的热量,则热化学方程式为
2NaOH(aq)+CO2(g)═Na2CO3(aq)+H2O(l)△H=-yKJ/mol②,
由盖斯定律可知,①-②可得,NaOH(aq)+CO2(g)═NaHCO3(aq)△H=-(4x-y)KJ/mol,
故选C.
点评 本题考查热化学方程式的书写和计算,是高考中常见题型,计算中涉及到化学方程式的有关计算问题和盖斯定律的有关应用,是一重点题型,学生还应注意在书写热化学方程式时标明各物质的状态.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应中氮元素被氧化 | |
| B. | 该反应中H2O2作还原剂 | |
| C. | 0.1mol•L-1NaCN溶液中含有HCN和CN-的总数为0.1×6.02×1023 | |
| D. | 实验室配制NaCN溶液时,需加入适量的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
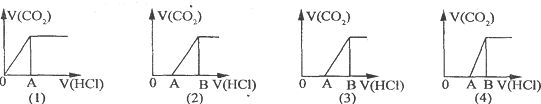
| A. | (1)图显示M中只有一种溶质且为Na2CO3 | |
| B. | (3)图显示M中有两种溶质且为Na2CO3.NaOH | |
| C. | (2)图显示M中有两种溶质且为Na2CO3.NaHCO3 | |
| D. | (4)图显示M中c(NaHCO3)=c(Na2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mn>Cu | B. | Al>Mn | C. | Mn>Mg | D. | Mn>H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在KMnO4溶液中:SO42-、Mg2+、CH3CH2OH、NO3- | |
| B. | 在由水电离的氢离子浓度为1×10-12mol/L的溶液中:Fe2+、Na+、NO3-、Cl- | |
| C. | 离子浓度相同的溶液中:CH3COO-、SO42-、NH4+、Cu2+ | |
| D. | 无色溶液中:Fe3+、NO3-、Na+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加入过量铁粉的方法除去Cu(NO3) 2溶液中混有的AgNO3 | |
| B. | 用NaOH溶液除去CO2中混有的HCl气体 | |
| C. | 向某无色未知溶液中加入BaCl2溶液,以检验未知溶液中是否含有SO42- | |
| D. | 用紫色石蕊试液、BaCl2溶液,将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
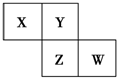 X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 四种元素的简单氢化物都为极性分子 | |
| B. | 最高价氧化物对应的水化物的酸性W比Z弱 | |
| C. | Z的单质与氢气反应较Y剧烈 | |
| D. | X、Y形成的化合物都易溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com