
| A. | 7.8g N2O2晶体中阴离子数目为0.2NA | |
| B. | 含1mol NH4Cl和少量NH3•H2O的中性溶液中,NH${\;}_{4}^{+}$数目为NA | |
| C. | 电解精炼铜时,阳极质量减少64g外电路导线上通过的e-数目为NA | |
| D. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA |
分析 A.过氧化钠中的阴离子为过氧根离子;
B.中性溶液中存在的电子守恒:c(Cl-)+c(OH-)=c(NH4+)+c(H+),依据氯离子的物质的量判断铵根离子;
C.电解精炼铜中,1mol铜失去2mol电子,据此判断;
D.在碱性溶液中水的电离受到抑制.
解答 解:A.7.8g过氧化钠的物质的量=$\frac{7.8g}{78g/mol}$=0.1mol,含有的阴离子是过氧根离子,物质的量为0.1mol,故A错误;
B.加入一定量的氨水后,溶液呈中性,c(H+)=c(OH-),据溶液中的电荷守恒:c(Cl-)+c(OH-)=c(NH4+)+c(H+),所以c(Cl-)=c(NH4+)=1mol,故B正确;
C.64gCu的物质的量=$\frac{64g}{64g/mol}$=1mol,失去的电子数为2mol,故C错误;
D.1L pH=13的NaOH溶液中,由水电离的OH-数目为10-13,故D错误,故选B.
点评 本题主要考查的是阿伏伽德罗常数以及物质的量的有关计算,掌握电中性原则以及会应用物质的量进行计算是解决本题的关键,难度不大.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:解答题
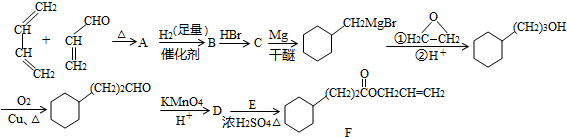
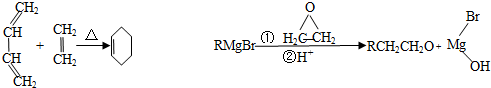
 ,A中所含官能团的名称是醛基、碳碳双键.
,A中所含官能团的名称是醛基、碳碳双键. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
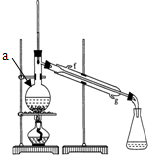 有人设计了一套实验分馏原油的五个步骤:
有人设计了一套实验分馏原油的五个步骤: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应在水溶液中进行时,若A为金属,则B一定是金属 | |
| B. | 反应在水溶液中进行时,若A为非金属,则B一定是非金属 | |
| C. | 反应在加热或高温下进行时,若A为金属,则B一定是非金属 | |
| D. | 反应在加热或高温下进行时,若A为非金属,则B一定是金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6 | B. | CH3COOH | C. | CH3CH2OH | D. | CH2OHCH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一氧化碳极易与血红蛋白结合,所以有毒 | |
| B. | 氧气易溶于水,所以鱼能生存 | |
| C. | 金刚石和石墨都是碳元素组成的单质,所以性质相似 | |
| D. | 溶液由溶质和溶剂组成,所以溶液体积等于溶质体积加溶剂体积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com