
”¾ĢāÄæ”æĻĀĮŠ¹ŲĻµŹ½“ķĪóµÄŹĒ( ”” )
A. CO2µÄĖ®ČÜŅŗ£ŗc(H+)£¾c(HCO3-)£¾2c(CO32-)
B. µČÅØ¶ČµÄHCNČÜŅŗÓėNaOHČÜŅŗµČĢå»ż»ģŗĻ£¬ĖłµĆČÜŅŗpH>7£¬ŌņČÜŅŗÖŠĄė×ÓÅØ¶Č£ŗc(Na+)£¾c(CN-) £¾c(OH-)£¾c(H+)
C. NaHCO3ČÜŅŗÖŠ“ęŌŚĖ®½āĘ½ŗā£ŗHCO3-+H2OH2CO3+OH-
D. Į½ÖÖČõĖįHXŗĶHY»ģŗĻŗó£¬ČÜŅŗÖŠµÄc(H+)ĪŖ(KaĪŖµēĄėĘ½ŗā³£Źż) ![]() +
+![]() + c(OH-)
+ c(OH-)
”¾“š°ø”æD
”¾½āĪö”æ
A£®CO2µÄĖ®ČÜŅŗÖŠ£¬Ģ¼Ėį²æ·ÖµēĄė³öĒāĄė×Ó£¬ČÜŅŗ³ŹĖįŠŌ£¬ÓÉÓŚĒāĄė×Ó»¹Ą“×ŌĖ®µÄµēĄė”¢HCO3-µÄµēĄė£¬Ōņc(H+)£¾c(HCO3-)£¬ÓÉÓŚµŚ¶ž²½µēĄė¼«Čõ£¬Ōņc(HCO3-)£¾£¾c(CO32-)£¬ĖłŅŌøĆČÜŅŗÖŠĄė×ÓÅØ¶Č“óŠ”ĪŖ£ŗc(H+)£¾c(HCO3-)£¾2c(CO32-)£¬¹ŹAÕżČ·£»B£®µČÅØ¶ČµÄHCNČÜŅŗÓėNaOHČÜŅŗµČĢå»ż»ģŗĻ£¬ĖłµĆČÜŅŗpH£¾7£¬Ōņc(OH-)£¾c(H+)£¬øł¾ŻµēŗÉŹŲŗćæÉµĆ£ŗc(Na+)£¾c(CN-)£¬ŌņČÜŅŗÖŠĄė×ÓÅØ¶Č“óŠ”ĪŖ£ŗc(Na+)£¾c(CN-)£¾c(OH-)£¾c(H+)£¬¹ŹBÕżČ·£»C£®HCO3-ÄÜĖ®½āÉś³ÉH2CO3”¢OH-£¬Ė®½ā·½³ĢŹ½ĪŖHCO3-+H2OH2CO3+OH-£¬¹ŹCÕżČ·£»D£®Į½ÖÖČõĖįHXŗĶHY»ģŗĻŗó£¬øł¾Ż¶žÕߵĵēĄėĘ½ŗā³£ŹżæÉÖŖČÜŅŗÖŠµÄc(H+)ĪŖ(KaĪŖµēĄėĘ½ŗā³£Źż)£ŗc(H+)=![]() =
=![]() £¬¹ŹD“ķĪó£»¹ŹŃ”D”£
£¬¹ŹD“ķĪó£»¹ŹŃ”D”£


 Č«ÄܲāæŲĘŚÄ©Š”דŌŖĻµĮŠ“š°ø
Č«ÄܲāæŲĘŚÄ©Š”דŌŖĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æCO2µČĪĀŹŅĘųĢåµÄÅÅ·ÅĖł“ųĄ“µÄĪĀŹŅŠ§Ó¦ŅŃ¾¶ŌČĖĄąµÄÉś“ę»·¾³²śÉśŗÜ“óÓ°Ļģ”£CO2µÄĄūÓĆŅ²³ÉĪŖČĖĆĒŃŠ¾æµÄČČµć”£ŅŌCO2ŗĶH2ĪŖŌĮĻŗĻ³É¼×“¼¼¼Źõ»ńµĆÓ¦ÓĆ”£
£Ø1£©ŅŃÖŖCH3OH (g)+![]() O2(g)===CO2(g)+2H2O(l ) ”÷H1=£363 kJ/mol
O2(g)===CO2(g)+2H2O(l ) ”÷H1=£363 kJ/mol
2H2(g)+O2(g)===2H2O(1) ”÷H2=£571.6kJ/mol
H2O(1)====H2O(g) ”÷H3=+44 kJ/ mol
ŌņCO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)µÄ·“Ó¦ČČ”÷H=___________”£
CH3OH(g)+H2O(g)µÄ·“Ó¦ČČ”÷H=___________”£
£Ø2£©øĆ·“Ó¦³£ŌŚ230~280”ę”¢1.5MPaĢõ¼žĻĀ½ųŠŠ”£²ÉÓĆ“ß»Æ¼ĮÖ÷ŅŖ×é·ÖĪŖCuO-ZnO-Al2O3”£“߻ƼĮ»īŠŌ×é·ÖĪŖµ„ÖŹĶ£¬Ņņ“Ė·“Ó¦Ē°ŅŖĶØĒāĘų»¹Ō”£Š“³öµĆµ½»īŠŌ×é·ÖµÄ·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ__________________________________________”£Ź¹ÓĆ²»Ķ¬“߻ƼĮŹ±£¬øĆ·“Ó¦·“Ó¦ČČ”÷H__________(Ģī”°ĻąĶ¬”±»ņ”°²»Ķ¬”±)
£Ø3£©øĆ·“Ó¦æÉŅŌæ“×÷ŅŌĻĀĮ½øö·“Ó¦µÄµž¼Ó£ŗ
CO2(g)+H2(g)![]() CO(g)+H2O(g)£¬Ę½ŗā³£ŹżK1£»
CO(g)+H2O(g)£¬Ę½ŗā³£ŹżK1£»
CO(g)+2H2(g)![]() CH3OH(g)£¬Ę½ŗā³£ŹżK2£»
CH3OH(g)£¬Ę½ŗā³£ŹżK2£»
ŌņCO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)µÄĘ½ŗā³£ŹżK=___________(ÓĆŗ¬K1”¢K2µÄ“śŹżŹ½±ķŹ¾)
CH3OH(g)+H2O(g)µÄĘ½ŗā³£ŹżK=___________(ÓĆŗ¬K1”¢K2µÄ“śŹżŹ½±ķŹ¾)
£Ø4£©·“Ó¦¹ż³ĢÖŠ£¬·¢ĻÖĪ²ĘųÖŠ×Ü»įŗ¬ÓŠŅ»¶ØÅØ¶ČµÄCO£¬ĪŖĮĖ¼õÉŁĘäÅØ¶Č£¬æÉŅŌ²ÉČ”µÄ“ėŹ©ĪŖ_________________________________(Š“Ņ»Ģõ¼“æÉ)
£Ø5£©ĪŖĮĖĢįøß·“Ó¦ĖŁĀŹ£¬²ÉČ”µÄ“ėŹ©æÉŅŌÓŠ___________”£
A.Ź¹ÓĆøߊ§“߻ƼĮ B.ŌŚ½ĻøßŃ¹ĒæĻĀ½ųŠŠ C.½µµĶŃ¹Ēæ D.³äČėøßÅضČCO2
£Ø6£©ÓŠČĖŃŠ¾æĮĖÓƵē»Æѧ·½·Ø°ŃCO2×Ŗ»ÆĪŖCH3OH£¬ĘäŌĄķČēĶ¼ĖłŹ¾£ŗ
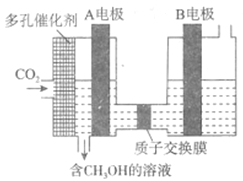
ŌņĶ¼ÖŠAµē¼«½ÓµēŌ“___________¼«”£ŅŃÖŖBµē¼«ĪŖ¶čŠŌµē¼«£¬ŌņŌŚĖ®ČÜŅŗÖŠ£¬øĆ¼«µÄµē¼«·“Ó¦ĪŖ______________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŅ»¶ØĪĀ¶ČĻĀ£¬±ł“×Ėį¼ÓĖ®Ļ”ŹĶ¹ż³ĢÖŠ£¬ČÜŅŗµÄµ¼µēÄÜĮ¦IĖę¼ÓČėĖ®µÄĢå»żV±ä»ÆµÄĒśĻßČēĶ¼ĖłŹ¾”£Ēė»Ų“š£ŗ

£Ø1£©”°O”±µćµ¼µēÄÜĮ¦ĪŖ0µÄĄķÓÉŹĒ_________________________”£
£Ø2£©a”¢b”¢cČżµć“¦£¬ČÜŅŗµÄc(H£«)ÓÉŠ”µ½“óµÄĖ³ŠņĪŖ____________”£
£Ø3£©a”¢b”¢cČżµć“¦£¬µēĄė³Ģ¶Č×ī“óµÄŹĒ________”£
£Ø4£©Čō½«cµćČÜŅŗÖŠc(CH3COO£)Ōö“ó£¬c(H£«)¼õŠ”£¬æɲÉČ”µÄ“ėŹ©ŹĒ:
¢Ł____________________________________________________£»
¢Ś___________________________________________________£»
¢Ū___________________________________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø1£©·“Ó¦3Fe£Øs£©+4H2O£Øg£©![]() Fe3O4£Øs£©+4H2£Øg£©ŌŚŅ»ČŻ»żæɱäµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬ŹŌ»Ų“š£ŗ
Fe3O4£Øs£©+4H2£Øg£©ŌŚŅ»ČŻ»żæɱäµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬ŹŌ»Ų“š£ŗ
¢ŁŌö¼ÓFeµÄĮ棬Ęä·“Ó¦ĖŁĀŹ____£ØĢī”°Ōö“ó”±”¢”°²»±ä”±»ņ”°¼õŠ””±£¬ĻĀĶ¬£©”£
¢Ś½«ČŻĘ÷µÄĢå»żĖõŠ”Ņ»°ė£¬Ęä·“Ó¦ĖŁĀŹ____”£
¢Ū±£³ÖĢå»ż²»±ä£¬³äČėHe£¬Ęä·“Ó¦ĖŁĀŹ____”£
¢Ü±£³ÖŃ¹Ēæ²»±ä£¬³äČėHe£¬Ęä·“Ó¦ĖŁĀŹ_____”£
£Ø2£©°±ĘųæÉ×÷ĪŖĶŃĻõ¼Į£¬ŌŚŗćĪĀŗćČŻĆܱÕČŻĘ÷ÖŠ³äČėŅ»¶ØĮæµÄNOŗĶNH3£¬ŌŚŅ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗ6NO£Øg£©+4NH3£Øg£©![]() 5N2£Øg£©+6H2O£Øg£©”£
5N2£Øg£©+6H2O£Øg£©”£
¢ŁÄÜĖµĆ÷øĆ·“Ó¦ŅŃ“ļµ½Ę½ŗāדĢ¬µÄ±źÖ¾ŹĒ____£ØĢī×ÖÄøŠņŗÅ£©
a.·“Ó¦ĖŁĀŹ5v£ØNH3£©=4v£ØN2£©
b.µ„Ī»Ź±¼äĄļĆæÉś³É5mol N2£¬Ķ¬Ź±Éś³É4mol NH3
c.ČŻĘ÷ÄŚN2µÄĪļÖŹµÄĮæ·ÖŹż²»ŌŁĖꏱ¼ä¶ų·¢Éś±ä»Æ
d.ČŻĘ÷ÄŚn(NO£©£ŗn£ØNH3£©£ŗn£ØN2£©£ŗn£ØH2O£©=6£ŗ4£ŗ5£ŗ6
¢ŚÄ³“ĪŹµŃéÖŠ²āµĆČŻĘ÷ÄŚNO¼°N2µÄĪļÖŹµÄĮæĖꏱ¼ä±ä»ÆČēĶ¼ĖłŹ¾£¬Ķ¼ÖŠv£ØÕż£©Óėv£ØÄę£©ĻąµČµÄµćĪŖ_____£ØŃ”Ģī×ÖÄø£©”£

£Ø3£©298KŹ±£¬ČōŅŃÖŖÉś³É±ź×¼×“æöĻĀ2.24LNH3Ź±·Å³öČČĮæĪŖ4.62kJ”£Š“³öŗĻ³É°±·“Ó¦µÄČČ»Æѧ·½³ĢŹ½____”£
£Ø4£©Ņ»¶ØĢõ¼žĻĀ£¬ŌŚ2LĆܱÕČŻĘ÷ÄŚ£¬·“Ó¦2NO2£Øg£©=N2O4£Øg£©”÷H=-180kJ”¤mol-1£¬n£ØNO2£©Ėꏱ¼ä±ä»ÆČēĻĀ±ķ£ŗ
Ź±¼ä/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
ÓĆNO2±ķŹ¾0”«2sÄŚøĆ·“Ó¦µÄĘ½¾łĖŁ¶Č____”£ŌŚµŚ5sŹ±£¬NO2µÄ×Ŗ»ÆĀŹĪŖ____”£øł¾ŻÉĻ±ķæÉŅŌ擳ö£¬Ėę×Å·“Ó¦½ųŠŠ£¬·“Ó¦ĖŁĀŹÖš½„¼õŠ”£¬ĘäŌŅņŹĒ____”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æµŖŃõ»ÆĪļ£ØNO2£©ŹĒŅ»ÖÖÖ÷ŅŖµÄ“óĘųĪŪČ¾Īļ£¬±ŲŠė½ųŠŠ“¦Ąķ”£
£Ø1£©Ęū³µ·¢¶Æ»ś¹¤×÷Ź±»įŅż·¢N2ŗĶO2·“Ӧɜ³ÉNO£¬Ęä·“Ó¦¹ż³ĢÖŠµÄÄÜĮæ±ä»ÆČēĻĀ£ŗ
·“Ó¦ | N2(g)”ś2N(g) | O2(g)”ś2O(g) | N(g)£«O(g)”śNO(g) |
·“Ó¦ČČ | ”÷H1 | ”÷H2 | ”÷H3 |
ČČĮæÖµkJ/mol | 945 | 498 | 630 |
¢Ł”÷H1___0£¬”÷H3____0”££ØĢī”°>”±»ņ”°<”±£©
¢ŚN2£Øg£©+O2£Øg£©=2NO£Øg£©”÷H=____kJ”¤mol-1”£
£Ø2£©ĄūÓĆ¼×Ķé“߻ƻ¹ŌµŖŃõ»ÆĪļ”£ŅŃÖŖ£ŗ
CH4£Øg£©+4NO2£Øg£©==4NO£Øg£©+CO2£Øg£©+2H2O£Øg£©”÷H=-574kJ”¤mol-l
CH4£Øg£©+4NO£Øg£©==2N2£Øg£©+CO2£Øg£©+2H2O£Øg£©AH=-1160 kJ”¤mol-l
H2O£Øl£©=H2O£Øg£©”÷H=+44kJ”¤mol-l
CH4ÓėNO2·“Ӧɜ³ÉN2ŗĶH2O(l)µÄČČ»Æѧ·½³ĢŹ½ĪŖ_______”£
£Ø3£©Ē±Ķ§ÖŠŹ¹ÓƵÄŅŗµŖ-ŅŗŃõČ¼ĮĻµē³Ų¹¤×÷ŌĄķČēĶ¼ĖłŹ¾£ŗ

¢Łµē¼«aĆū³ĘŹĒ______”£
¢Śµē½āÖŹČÜŅŗÖŠOH-Ąė×ÓĻņ_____ŅĘ¶Æ£ØĢī”°µē¼«a”±»ņ”°µē¼«b”±£©”£
¢Ūµē¼«bµÄµē¼«·“Ó¦Ź½ĪŖ_____”£
£Ø4£©æÉĶعżNH3ÓėNaClO·“Ó¦Ą“Öʵƻš¼żČ¼ĮĻėĀ£ØN2H4£©”£øĆ·“Ó¦µÄ»Æѧ·“Ó¦·½³ĢŹ½ŹĒ_____”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĀČ»ÆŃĒĶ(CuCl)æÉÓĆ×÷“߻ƼĮ”¢É±¾ś¼Į”¢Ć½Č¾¼Į”¢ĶŃÉ«¼Į”£CuClŹĒŅ»ÖÖ°×É«·ŪÄ©£¬Ī¢ČÜÓŚĖ®”¢²»ČÜÓŚŅŅ“¼£¬ŌŚ³±ŹŖµÄæÕĘųÖŠŅ×±»Ńõ»Æ”£ŹµŃéŹŅ²ÉÓĆČēĶ¼×°ÖĆŗĶĻĀĮŠ²½ÖčÖʱøĀČ»ÆŃĒĶ”£
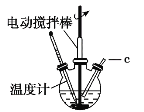
²½Öč1£ŗŌŚČż¾±ÉÕĘæÖŠ¼ÓČė20%ŃĪĖį”¢Ź³ŃĪ”¢ĶŠ¼£¬¼ÓČČÖĮ60”«70”ę£¬æŖ¶Æ½Į°čĘ÷£¬Ķ¬Ź±“ÓcæŚ»ŗĀżĶØČėŃõĘų£¬ÖʵĆNa[CuCl2]ČÜŅŗ”£
²½Öč2£ŗ·“Ó¦ĶźČ«ŗó£¬ĄäČ“£¬¹żĀĖ£¬ĀĖŅŗÓĆŹŹĮæµÄĖ®Ļ”ŹĶ£¬Īö³öCuCl”£
²½Öč3£ŗ¹żĀĖ£¬·Ö±šÓĆŃĪĖį”¢ŅŅ“¼Ļ“µÓĀĖ³öµÄ¹ĢĢ唣
²½Öč4£ŗŌŚÕęæÕøÉŌļĘ÷ÖŠ60”«70 ”ęøÉŌļ2h£¬ĄäČ“ŗóµĆµ½²śĘ·”£
»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)ÖŹĮæ·ÖŹżĪŖ20%µÄŃĪĖįĆܶČĪŖ1.1g/cm3£¬ĪļÖŹµÄĮæÅضČĪŖ___________£»ÅäÖĘ20%ŃĪĖįŠčŅŖµÄ²£Į§ŅĒĘ÷ÓŠ£ŗ__________”¢ÉÕ±”¢²£Į§°ō”¢½ŗĶ·µĪ¹Ü”£
(2)²½Öč1ÖŠÖʵĆNa[CuCl2]µÄ»Æѧ·½³ĢŹ½ĪŖ________________________________”£
(3)øł¾Ż”°²½Öč2ÖŠÓĆĖ®Ļ”ŹĶĀĖŅŗÄܵƵ½CuCl”±ĶĘ²ā£¬ĀĖŅŗÖŠ“ęŌŚµÄĘ½ŗāŹĒ____________”£
(4)Īö³öµÄCuCl¾§Ģå²»ÓĆĖ®¶ųÓĆŃĪĖį”¢ŅŅ“¼·Ö±šĻ“µÓµÄÄæµÄŹĒ__________________”£
(5)²ā¶Ø²śĘ·ÖŠĀČ»ÆŃĒĶµÄÖŹĮæ·ÖŹż£¬ŹµŃé¹ż³ĢČēĻĀ£ŗ
×¼Č·³ĘČ”ÖʱøµÄĀČ»ÆŃĒĶ²śĘ·0.25 g£¬½«ĘäÖĆÓŚ×ćĮæµÄFeCl3ČÜŅŗÖŠ£¬“żŃłĘ·Č«²æČܽāŗ󣬼ÓČėŹŹĮæĻ”ĮņĖį£¬ÓĆ0.10 mol/LµÄĮņĖįīę[Ce(SO4)2]±ź×¼ČÜŅŗµĪ¶Øµ½ÖÕµć£¬ĻūŗÄĮņĖįīęČÜŅŗ24.50 mL£¬·“Ó¦ÖŠCe4+±»»¹ŌĪŖCe3+”£(ŅŃÖŖ£ŗCuCl+FeCl3=CuCl2+FeCl2)
¢ŁĮņĖįīę±ź×¼ČÜŅŗÓ¦Ź¢·ÅŌŚ________(Ģī”°Ėį”±»ņ”°¼ī”±)Ź½µĪ¶Ø¹ÜÖŠ”£
¢Ś²śĘ·ÖŠĀČ»ÆŃĒĶµÄÖŹĮæ·ÖŹżĪŖ________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŌŖĖŲÖÜĘŚ±ķÖŠ£¬ŌŖĖŲŠŌÖŹĖęŌ×ÓŠņŹżµÄµŻŌö³ŹĻÖÖÜĘŚŠŌ±ä»ÆµÄ±¾ÖŹŌŅņŹĒ£Ø £©
A.ÖŠ×ÓŹżÖš½„Ōö¶ą
B.Ļą¶ŌŌ×ÓÖŹĮæÖš½„Ōö“ó
C.ŗĖĶāµē×ÓÅŲ¼³ŹĻÖÖÜĘŚŠŌ±ä»Æ
D.ŌŖĖŲ»ÆŗĻ¼Ū³ŹĻÖÖÜĘŚŠŌ±ä»Æ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æAOHĪŖČõ¼ī£¬ŅŃÖŖ£ŗ2AOH(aq)£«H2SO4(aq)===A2SO4(aq)£«2H2O(l)””¦¤H1£½£24.2 kJ”¤mol£1£»H£«(aq)£«OH£(aq)===H2O(l)””¦¤H2£½£57.3 kJ”¤mol£1”£ŌņAOHŌŚĖ®ČÜŅŗÖŠµēĄėµÄ¦¤HĪŖ(””””)
A. £«33.1 kJ”¤mol£1 B. £«45.2 kJ”¤mol£1 C. £81.5 kJ”¤mol£1 D. £33.1 kJ”¤mol£1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČēĶ¼ŹĒŅ»¶ØĢõ¼žĻĀN2ÓėH2·“Ó¦¹ż³ĢÖŠÄÜĮæ±ä»ÆµÄĒśĻßĶ¼”£ĻĀĮŠŠšŹöÕżČ·µÄŹĒ

A. øĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗN2+3H2![]() 2NH3 ”÷H=£92kJ”¤mol£1
2NH3 ”÷H=£92kJ”¤mol£1
B. aĒśĻߏĒ¼ÓČė“߻ƼĮŹ±µÄÄÜĮæ±ä»ÆĒśĻß
C. ¼ÓČė“߻ƼĮ£¬øĆ»Æѧ·“Ó¦µÄ·“Ó¦ČČ½«·¢Éśøıä
D. ŌŚĻąĶ¬ĪĀ¶ČµÄĢõ¼žĻĀ£¬ŌŚĢå»żĻąĶ¬I”¢IIĮ½øöČŻĘ÷ÖŠ·Ö±šĶØČė1mol N2ŗĶ3 mol H2£¬ČŻĘ÷IĢå»żŗć¶Ø£¬ČŻĘ÷IIĢå»żæɱ䱣³ÖŗćŃ¹£¬Ōņ·“Ó¦¹ż³ĢÖŠĮ½ČŻĘ÷ÄŚµÄ·“Ó¦ĖŁĀŹv(I)£¼v(II)
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com