
| 物质 编号 | 甲 | 乙 | 丙 | 丁 | 物质转化关系 |
| A | Cu | CuCl2 | CuO | Cu(NO3)2 |  |
| B | Na2CO3 | NaOH | NaHCO3 | CO2 | |
| C | Fe | Fe Cl3 | Fe(OH)3 | Fe2O3 | |
| D | Al2O3 | Al(OH)3 | NaAlO2 | AlCl3 |
| A、A | B、B | C、C | D、D |


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:
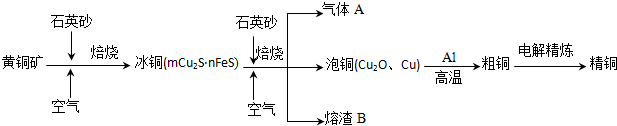
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1molCl2常温下与过量NaOH溶液反应转移电子总数为0.1NA |
| B、25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA |
| C、0.25molNa2O2中含有的阴离子数为0.5NA |
| D、18gD2O(重水)完全电解,转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、消耗的硝酸的量:①>②>③ |
| B、铜与浓硝酸作用最快,故最佳方案是① |
| C、对环境造成的危害,③最小 |
| D、三种途径所消耗的铜的质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若固体完全溶解,则粉末中不可能有Cu2O |
| B、若固体不能完全溶解,则粉末中肯定有Cu2O |
| C、若固体完全溶解,溶液中再加KSCN,变红,则原粉末仅是Fe2O3 |
| D、若固体不能完全溶解,溶液中再加KSCN,不变红,则原粉末仅是Cu2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
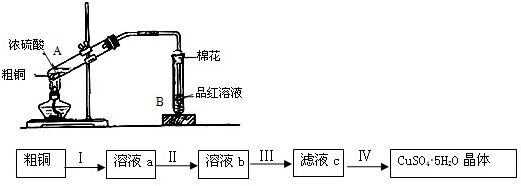
查看答案和解析>>
科目:高中化学 来源: 题型:
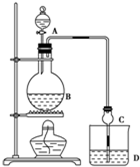 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
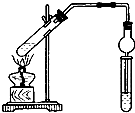 用如图所示实验装置制取乙酸乙酯.回答以下问题:
用如图所示实验装置制取乙酸乙酯.回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com