
����Ŀ�����ڰ�����व�ͭ��������л����Գƺϳ�������յ�ЧӦ����ṹ��ʽ��ͼ����ʾ��
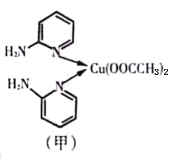
(1)��̬Cuԭ�ӵļ۵����Ų�ʽΪ__________________����Ԫ�����ڱ���ͭλ��_____��(�s������P������d����ds��)
(2)C��N��O��һ�������ɴ�С��˳��Ϊ________________��
(3)�ڰ�����व�ͭ������У�Cu2+����λ����___________��Nԭ�ӵ��ӻ�����Ϊ_____________��
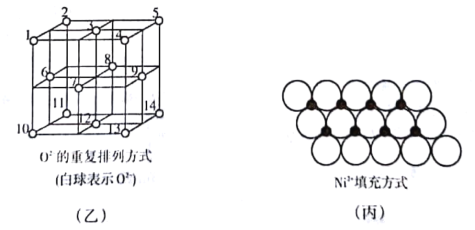
(4)��ͼ����ʾ��Fe3O4�������У�O2-Χ�����������϶(1��3��6��7����Χ��)�����������϶(3��6��7��8��9��12����Χ��)��Fe3O4����һ���Fe3+��������������϶�У�Fe2+����һ��Fe3+��������������϶�У����������������϶�����������϶��֮��Ϊ___________����_______________%�����������϶û����������ӡ�
(5)һ���¶��£�NiO��������Է��ط�ɢ���γɡ������Ӳ㡱��������ΪO2-�����õ������У�Ni2+�������(��ͼ��)����֪O2-�İ뾶Ϊa nm��ÿƽ��������Ϸ�ɢ�ĸþ��������Ϊ________g(��a��NA��ʾ)��
���𰸡�![]() ds N>O>C 4 sp2��sp3 2:1 50
ds N>O>C 4 sp2��sp3 2:1 50 
��������
��1��Cu��29��Ԫ�أ���������Ų�ʽΪ![]() �����ڹ���Ԫ�أ��۵��Ӱ���3d��4s���ӣ��۵����Ų�ʽΪ
�����ڹ���Ԫ�أ��۵��Ӱ���3d��4s���ӣ��۵����Ų�ʽΪ![]() ����Ԫ�����ڱ���ͭλ��ds����
����Ԫ�����ڱ���ͭλ��ds����
��2��ͬ��������Ԫ����ԭ�����������һ�����ܳ��������ƣ�����A�塢��A��Ԫ������ܼ�Ϊȫ�����������ȶ�״̬����һ�����ܸ���ͬ��������Ԫ�صģ��ʵ�һ�����ܣ�N>O>C��
��3��Cu2+�γ�4����λ����Cu2+����λ����4���γ���λ����Nԭ�ӣ�û�йµ��Ӷԣ��ӻ������ĿΪ3��Nԭ�Ӳ�ȡsp2�ӻ�����������Nԭ���γ�3��![]() ��������1�Թµ��Ӷԣ�Nԭ���ӻ������ĿΪ4��Nԭ�Ӳ�ȡsp3�ӻ���
��������1�Թµ��Ӷԣ�Nԭ���ӻ������ĿΪ4��Nԭ�Ӳ�ȡsp3�ӻ���
��4���ṹ����1��3��6��7��O2Χ�ɵ����������϶��8��������λ��6��O2Χ�ɵ��������壬��������ȫ��֪����1�����4����������ⶥ��O2ҲΧ���������壬����������������Ϊ4���������У�����������������Ŀ��1+12��14=4�����������������϶�����������ݿ�϶��֮��Ϊ8:4��2:1����ͼ��֪����ṹ��O2������ĿΪ8��18+6��12=4���ɻ�ѧʽ��֪������Feԭ����ĿΪ3�����ݻ��ϼ۴�����Ϊ0�����к���2��Fe3+��1��Fe2+��Fe3O4����һ���Fe3+��������������϶�У���һ��Fe3+��Fe2+��������������϶�У�����������������϶�е�Fe3+Ϊ1������������������϶����1��Fe3+��1��Fe2+����2�����������϶��϶û����������ӣ�����50%�����������϶û����������ӣ�
��5������ͼ֪��ÿ��Niԭ�ӱ�3��Oԭ�Ӱ�Χ��ÿ��Oԭ�ӱ�3��Niԭ�Ӱ�Χ����ͼ ��ʾ�����ڵ�3��Բ��������Ϊ�������Σ������εı߳�Ϊ2anm��ÿ�������κ���һ��Niԭ�ӣ������ε����
��ʾ�����ڵ�3��Բ��������Ϊ�������Σ������εı߳�Ϊ2anm��ÿ�������κ���һ��Niԭ�ӣ������ε����![]() ����ͼ
����ͼ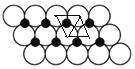 ʵ����ÿ��Niԭ�ӱ�����С�����ΰ���Сƽ���ı������Ϊ
ʵ����ÿ��Niԭ�ӱ�����С�����ΰ���Сƽ���ı������Ϊ![]() ��Oԭ�Ӹ���=16��6��1��ÿƽ��������Ϸ�ɢ�ĸþ��������
��Oԭ�Ӹ���=16��6��1��ÿƽ��������Ϸ�ɢ�ĸþ��������![]() ��
��


 �ִʾ��ƪϵ�д�
�ִʾ��ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���Ʊ����跴Ӧ���Ȼ�ѧ����ʽ���£�SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) ����=+QkJ/mol(Q>0)��ij�¶ȡ�ѹǿ�£���һ������Ӧ��ͨ���ܱ������������Ϸ�Ӧ������������ȷ���ǣ� ��
Si(s)+4HCl(g) ����=+QkJ/mol(Q>0)��ij�¶ȡ�ѹǿ�£���һ������Ӧ��ͨ���ܱ������������Ϸ�Ӧ������������ȷ���ǣ� ��
A.��Ӧ�����У�������ѹǿ�����SiCl4��ת����
B.����Ӧ��ʼʱSiCl4Ϊ1mol�����ƽ��ʱ����������ΪQkJ
C.��Ӧ��2minʱ����HClŨ��Ϊ0.12mol/L����H2�ķ�Ӧ����0.03mol/(L��min)
D.����Ӧ��������0.25QkJʱ�����ɵ�HClͨ�뺬0.1mol NaOH����Һǡ�÷�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�����������˵����ȷ����
A. ���³�ѹ�£�8gO2��O3�Ļ�����庬��4NA������
B. 1L0.1mol/L��FeCl3��ȫˮ�⣬�γ�0.1NA��Fe(OH)3��������
C. ��״���£�22.4LCl2ͨ��ˮ�з�����Ӧ��ת�Ƶĵ�����ΪNA
D. 1molNa����ȫ��������Na2O2��ʧȥ��2NA����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����������װ����ȡ������������������ʵ�顣�ش��������⣺
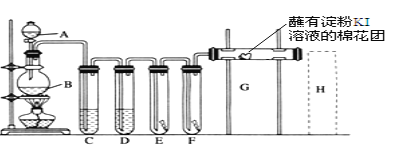
(1)A��ʢ��Ũ���ᣬB��ʢ��MnO2��д����Ӧ�Ļ�ѧ����ʽ___________��
(2)D�з���ŨH2SO4����Ŀ����________��
(3)E��Ϊ��ɫ�ɲ�����F��Ϊ��ɫʪ�������ɹ۲쵽��������________���Ա�E��F������IJ���ɵó��Ľ��ۼ�����____________________________��
(4)G�ǽ��е���KI��Һ������G�����������������______����Ӧ�����ӷ���ʽ��______________��H�ǽ���NaBr��Һ������H�����������������______��
(5)����H��β������װ��ͼ��ע���Լ�________��
(6)������һ����Ϊ����ˮ�衱�IJ�ƷҲ�ܶ�����ˮ���п��ٵ�ɱ��������ҩ��ͨ�����������㡣�������ț�Cl2Na(NCO)3����ˮ��Ӧ�����ɴ�������ɱ���������ã������Ӻ��ڲ����������(Na2SO3)�ܳ����ɽ�ˮ�е�����(�������)��ȥ���������ƽ�ˮ�ж���������ȥ�����ӷ�Ӧ����ʽΪ________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ת����ϵ���ش����⣺

��֪������CH3Br![]() CH3��HBr��
CH3��HBr��
��C���ʱ�����һ±����ֻ�����֡�
(1)д��B���ʵ�����__________��D���ʵĽṹ��ʽ________��
(2)д����Ӧ��������________����Ӧ��������________��
(3)д����Ӧ���Ļ�ѧ����ʽ��________________________________��
(4)д��D��E��Ӧ�Ļ�ѧ����ʽ��_______________��
(5)��Ӧ�����п�������һ��C16H18���л���䱽����һ±����Ҳֻ�����֣�д�����Ľṹ��ʽ��_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˼������ˮ��IJ���������ʵ�鷽����
![]()
��ش��������⣺
��1���Լ�1Ϊ20%��H2SO4��Һ����������_________��
��2���Լ�2Ϊ_________����������_________��ʹ����ˮ������ʵ�����˳�����У�������Ӧ�����ӷ���ʽΪ��_________��
��3����Ӧ�ٵĻ�ѧ����ʽΪ_________��
��4��Ϊ�������Һ�Ƿ�����ȫˮ�⣬ȡ����ˮ��Һ���Թ��У������ˮ����֤������δ��ȫˮ���������_________��
��5�����ʵ�������û�м����Լ�2��ֱ�Ӽ�������������ͭ����Һ���ܷ�ʵ��ʵ��Ŀ��_________���������������������������ܣ���ԭ����_________����ĸ�����ʩ��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ�������
A. �����£�0.2 mol Fe������ˮ������Ӧ�����ɵ�H2������ĿΪ0.3NA
B. �����£�1 L pH=13��NaOH��Һ�У���ˮ�����OH��������ĿΪ0.1NA
C. ����ȼ�ϵ����������22.4 L����״��������ʱ����·��ͨ���ĵ�����ĿΪ2NA
D. 5NH4NO3![]() 2HNO3+4N2��+9H2O��Ӧ�У�����28 g N2ʱ��ת�Ƶĵ�����ĿΪ3.75NA
2HNO3+4N2��+9H2O��Ӧ�У�����28 g N2ʱ��ת�Ƶĵ�����ĿΪ3.75NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ���й�����ˮ��Ӧ����������ʵ��װ�á�ʵ�鿪ʼʱ������ڼ�����з�̪��Һ��ˮ��ʹˮλ�ﵽB�˹ܿڣ�Ȼ��Ѹ�������������ε���ͷ�룬��ʱNa����ˮ�С��ش��������⣺
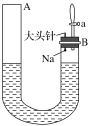
(1)����ˮ��Ӧ�Ļ�ѧ����ʽΪ_____________��
(2)����ˮ��Ӧ�������кܶ࣬��ͬ������֤����ͬ�����ʡ�
����֤���Ƶ��ܶȱ�ˮС��������_________��
����֤���Ƶ��۵�͵�������_________��
����֤���������������ɵ�������__________��
����֤�������������������A��Һ��________(�������������½�����������������ͬ)��B��Һ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������Ҫ22.4L(��״��)SO2���塣��ѧС��ͬѧ���ݻ�ѧ����ʽZn+2H2SO4(Ũ)=ZnSO4+SO2��+2H2O�����,ȡ65.0gп����98%��ŨH2SO4(��=1.84g/cm3)110mL��ַ�Ӧ,пȫ���ܽ�,�����Ƶõ�����,��ͬѧ��Ϊ���ܻ������ʡ�
(1)��ѧС�����Ƶõ������л��е���Ҫ�������������_______(�����ʽ)���������ֽ������Ҫԭ����_______________________(�û�ѧ����ʽ�ͱ�Ҫ�����ּ���˵��)��
(2)Ϊ֤ʵ��ط���,��ѧС���ͬѧ�����ʵ��,��װ������װ��,������ȡ���������̽����

��װ��B�м�����Լ�_______,��Ӧ�����ӷ���ʽ��______________��
��װ��D������Լ�������_______,װ��F������Լ��Լ�������_______��
�ۿ�֤ʵһ������п����һ������Ũ���ᷴӦ�����ɵ������л���ij���������ʵ��������______________����U�ι�G������Ϊ______________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com