
【题目】五种短周期元素X、Y、Z、L、M,原子序数依次递增。X是原子半径最小的元素,Y的最高正价和最低负价的代数和为0,Z的气态氢化物和它的最高价氧化物对应的水化物能发生化合反应,L的最外层电子数是次外层的3倍,M是地壳中含量最高的金属元素。
回答下列问题:
(1)五种元素的原子半径从大到小的顺序是______(用元素符号表示)。
(2)X能分别与Y、Z、L形成具有相同电子数的化合物A、B、C。实验室制取B的化学方程式为______。
(3)Z的最高价氧化物对应水化物与M的最高价氧化物对应水化物反应的离子方程式为_______。
(4)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为______。
【答案】Al>C>N>O>H 2NH4Cl + Ca(OH)2![]() CaCl2 + 2NH3↑+2H2O 3H++ Al(OH)3= Al3++3H2O 34 H2SeO4
CaCl2 + 2NH3↑+2H2O 3H++ Al(OH)3= Al3++3H2O 34 H2SeO4
【解析】
X、Y、Z、L、M五种短周期元素的原子序数依次增大,X是原子半径最小的元素,则X为H元素;Z的气态氢化物和它的最高价氧化物对应的水化物能发生化合反应,则Z为N元素;Y的最高正价和最低负价的代数和为0,Y为第ⅣA族,为C元素;M是地壳中含量最高的金属元素,则M为Al元素;L的最外层电子数是次外层的3倍,最外层有6个电子,为O元素,据此分析解答。
根据上述分析,X为H元素;Y为C元素,Z为N元素,L为O元素,M为Al元素。
(1)同周期自左而右,原子半径减小、同主族自上而下,原子半径增大,所有元素中H原子半径最小,故原子半径:Al>C>N>O>H,故答案为:Al>C>N>O>H;
(2)X能分别与Y、Z、L形成具有相同电子数的化合物A、B、C,其中B为氨气,实验室制取氨气的化学方程式为2NH4Cl + Ca(OH)2![]() CaCl2 + 2NH3↑+2H2O,故答案为:2NH4Cl + Ca(OH)2
CaCl2 + 2NH3↑+2H2O,故答案为:2NH4Cl + Ca(OH)2![]() CaCl2 + 2NH3↑+2H2O;
CaCl2 + 2NH3↑+2H2O;
(3)Z的最高价氧化物对应水化物为硝酸,M的最高价氧化物对应水化物为氢氧化铝,二者反应生成硝酸铝和水,反应的离子方程式为3H++ Al(OH)3= Al3++3H2O,故答案为:3H++ Al(OH)3= Al3++3H2O;
(4)L为O元素,Se与O同一主族,Se原子比O原子多两个电子层,则Se的原子序数为8+8+18=34,其最外层电子数为6,则最高化合价为6,最高价氧化物对应的水化物化学式为H2SeO4,故答案为:34;H2SeO4。


科目:高中化学 来源: 题型:
【题目】2019年10月9日,瑞典皇家科学院宣布2019年度诺贝尔化学奖授予在锂离子电池的发展方面做出贡献的科学家。某高能![]() 电池,多应用于公共交通。电池工作时结构如图所示,电池中间是聚合物的隔膜,主要作用是在反应过程中只让
电池,多应用于公共交通。电池工作时结构如图所示,电池中间是聚合物的隔膜,主要作用是在反应过程中只让![]() 通过,电池工作时总反应可以表示为:
通过,电池工作时总反应可以表示为:![]() 。下列说法不正确( )
。下列说法不正确( )
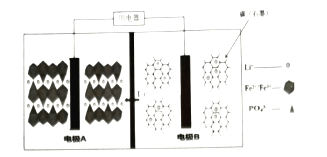
A.电池工作时,电极B为负极
B.充电时,电极A上的电势比电极B上的高
C.电池工作时,A极电极反应式:![]()
D.充电时,以铅蓄电池为电源,则电极A与![]() 电极相连
电极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水约占地球表面积的71%,具有十分巨大的开发潜力。下图是开水资源综合利用的工艺图,以下说法正确( )

A. 电解NaCl溶液时可用铁做电极,其离子方程式为:2Cl- + 2H2O = 2OH-+ H2↑+ Cl2↑
B. 向苦卤中加入Cl2的作用是置换出溴单质,该过程体现了还原性:Cl- > Br-
C. 实验室模拟海水提取淡水,除夹持装置外只用到的仪器有蒸馏烧瓶、酒精灯、锥形瓶
D. Br2 与SO2的水溶液发生反应的离子方程式为:Br2 + SO2 + 2H2O =4H+ + 2Br- + SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铜是制备Cu—Zn—Al系催化剂的重要原料,制取硝酸铜现有三种设计方案可供选用:①Cu与稀硝酸反应制取,②Cu与浓硝酸反应制取,③通氧气于铜屑与稀硝酸的体系中制取:2Cu+4HNO3+O2=2Cu(NO3)2+2H2O。下列说法正确的是( )
A.制取相同量的硝酸铜需硝酸的量③最多
B.制取相同量的硝酸铜①产生的有毒气体比②多
C.三种方案中硝酸的利用率③>①>②
D.三种方案的反应都可以在铁制容器中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)元素周期表中第VIIA族元素的单质及其化合物的用途广泛。
①与氯元素同族的短周期元素的原子结构示意图为______。
②能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是____。
a. Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c. HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
③设计一个实验方案,证明氧化性Cl2>Br2:___________。
(2)铅是碳的同族元素,比碳多4个电子层。
①铅在元素周期表的位置为_______。
②PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有大量的Mg2+、Al3+、H+、Cl-和少量OH-,向该溶液中逐滴加入0.5 mol·L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积之间的关系如下图所示,则可判断原溶液中( )

A. 有Mg2+,没有Al3+
B. 有Al3+,没有Mg2+
C. 有Mg2+和Al3+
D. 有大量的H+、Mg2+和Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L.
阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
阴离子 | Cl﹣ CO32﹣ NO3﹣ SO42﹣ SiO32﹣ |
甲同学欲探究废水的组成,进行了如下实验:
I.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是_____________(写离子符号)。
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是_______。
(3)将Ⅲ中红棕色气体(标况下)收集一试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为_________mol/L(精确到千分位)。
(4)甲同学最终确定原溶液中所含阳离子是___________,阴离子是_______。
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体为_________________,质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X:可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42-、SiO32-、NO3-中的一种或几种离子,取该溶液进行实验,转化关系如图所示。反应过程中有一种气体在空气中会变为红棕色。回答下列问题:

(1)沉淀C是___(填化学式),由此可确定溶液X中肯定不存在的阳离子有___。
(2)气体A是___(填化学式),产生气体A的离子方程式为___。
(3)步骤④中发生反应的离子方程式为___。
(4)根据题给信息和图中转化关系,可以确定溶液X中肯定存在的离子有___,可能存在的离子有___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】祖母绿被称为绿宝石之王,是国际珠宝世界公认的四大名贵宝石之一,其化学式为Be3Al2Si6O18。回答下列问题:
(1)基态Be原子的电子排布图为____________,基态Al原子核外电子占据________个轨道,其中能量最高能级的原子轨道的形状为__________。
(2)Al、Si、O的第一电离能由大到小的排序为____________________。
(3)SO3分子中硫原子的杂化类型是_____,SO3分子的空间构型是________。
(4)工业上,电解制取金属铝,不能用熔融的AlCl3,AlCl3的晶体类型是__________,将Be3Al2Si6O18写为氧化物的式子是_____________________。
(5)LiAlH4在有机合成中可将羧基还原成羟基。甲酸和乙醇的熔、沸点如图所示:

1mol甲酸分子中σ键与π键的比值为________________,甲酸和乙醇的熔点相差较大的主要原因是____________________________________________。
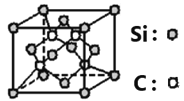
(6)碳化硅的晶体类型类似金刚石,晶胞结构如图所示。已知:碳化硅的晶体密度为ag/cm3,NA代表阿伏伽德罗常数的数值。该晶胞边长为_____________pm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com