
一定量的铁与稀盐酸反应,生成了4.48 L(STP)氢气.
(1)计算发生反应的氯化氢和铁的物质的量分别为多少?
(2)若所用盐酸的浓度为0.5 mol·L-1,则至少需要盐酸的体积为多少升?
科目:高中化学 来源: 题型:阅读理解
| ||
| ||

查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省威海市高三下学期第一次模拟考试化学试卷(解析版) 题型:填空题
氯化铜、氯化亚铜是重要的化工原料,广泛地用作有机合成催化剂。
实验室中以粗铜(含杂质Fe)为原料,某种制备铜的氯化物的流程如下。
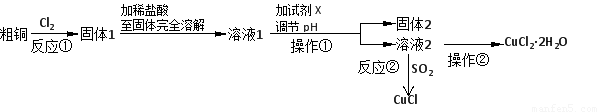
按要求回答下列问题:
(1)操作①的名称是______________,检验溶液2中是否含有杂质离子的试剂是?????????????????? 。操作②需在氯化氢气流中经过加热浓缩、??????? 、过滤、洗涤、干燥。
(2)上述流程中,所得固体1需要加稀盐酸溶解,其理由是??????????????????????? ;
溶液1可加试剂X用于调节pH以除去杂质, X可选用下列试剂中的(填序号)___________。
a.NaOH???????? b.NH3·H2O??????? c.CuO?????? d.CuSO4
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式: ????????????????????? 。
(4)现用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)。
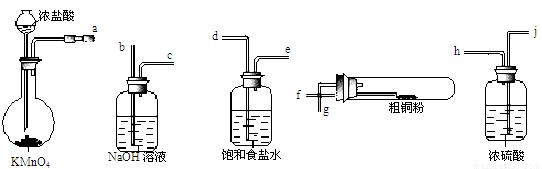
①按气流方向连接各仪器接口顺序是:a→?? 、 → 、 → 、 → 。实验开始前要进行一步重要操作,其操作名称是?????????????????????????? 。
②反应时,盛粗铜粉的试管中的现象是?????????????????? ??????????? 。
③反应后,盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化腐蚀过程中的正极反应式为??????????????? 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com