
 ��ijѧ����0.2000mol•L-1�ı�NaOH��Һ�ζ�δ֪Ũ�ȵ����ᣬ������ɷ�Ϊ���¼�����
��ijѧ����0.2000mol•L-1�ı�NaOH��Һ�ζ�δ֪Ũ�ȵ����ᣬ������ɷ�Ϊ���¼��������� ��1���ζ���������ˮϴ�������ϴ����ƿ������ϴ���ζ��յ�����ɫ�ı���ڰ�����ڲ��仯��
��2��������ʽ�ζ��ܣ����Ǽ�ʽ�ζ��ܣ�
��3������c�����⣩=$\frac{c��������V������}{V�����⣩}$��������������V��������Ӱ�죬�Դ��ж�Ũ�ȵ���
��4���ζ�ʱ�����ֿ��Ƶζ��ܣ�����ҡ����ƿ���۾�ע����ƿ����Һ��ɫ�仯��
��5���������ӳ�����ȫʱ��������������Ũ������Ϊamol/L�������������������ܽ�ƽ��ɼ�����������Ũ�ȣ��ټ���PH��
��6���������ʵ����ʺ������غ㶨����д��ѧ����ʽ��
��7����Ϊ����KSCN��ָʾ�����յ�ʱNH4Fe��SO4��2���ٷ�Ӧ��Fe3+��SCN-����Ѫ��ɫ��Fe��SCN��3��
��8��Fe3+��Ti3+��Ӧ������Fe2+��Ti4+�����ݵ�ʧ�����غ㣬��n��Ti3+����1=n��Fe3+����1����n��Fe3+��=n��Ti3+��=n��TiO2��=cV��10-3mol���ݴ˼���������������
��� �⣺��1���ٵζ���������ˮϴ����ϴ��ʹ��Һ��Ũ�ȼ�С�����ĵ�������ⶨ���ƫ�����Ա���������������Һ��ϴ���ʢٲ�������
�����ô���Һ��ϴ��ƿ����ʹ����Һ�������ʵ������ӣ����ı�Һ��������ⶨ���ƫ��������ƿ������ϴ���ʢܲ�������
�ݵ���һ�α�Һ����Һ��ɫ����ɫ��Ϊ��ɫ����ֹͣ�ζ�����ʱδ���յ㣬Ӧ����ɫ��Ϊ��ɫ�Ұ�����ڲ��ٸı䣬�ζ��������ʢݲ�������
�ʴ�Ϊ���٢ܢݣ�
��2����������Ӧ���ü�ʽ�ζ��ܣ���ѡ�ң�
�ʴ�Ϊ���ң�
��3������c�����⣩=$\frac{c��������V������}{V�����⣩}$��������������V��������Ӱ�죺
A����ʽ�ζ���δ��ϴ������Һ��ϡ�ͣ�Ũ�ȱ�С�����ı�Һ�������С��ʹ�ζ����ƫС����A������
B���ζ�ǰ���ζ��ܼ��������ݣ��ζ��������ݣ����ĵı�Һ�������С��ʹ�ζ����ƫС����B������
C����ƿ��������ˮϴ�Ӻ�δ�ô���Һ��ϴ����Ӱ��ζ��������C������
D���ζ�����ʱ���ӵζ��ܣ�����¼���ݣ�ʹ��Һ�����ƫ��ʹ�ζ����ƫ��D��ѡ��
E���ζ���������һ�α�Һ�ɽ�����ƿ�����ĵı�Һ���������ʹ�ζ����ƫ��E��ѡ��
�ʴ�Ϊ��DE��
��4���ζ�ʱ�����ֿ��Ƶζ��ܣ�����ҡ����ƿ���۾�ע����ƿ����Һ��ɫ�仯��
�ʴ�Ϊ����ƿ����Һ��ɫ�仯��
��5���������ӳ�����ȫʱ��������������Ũ��Ϊ����Ϊamol/L�������������������ܽ�ƽ��Al��OH��3?Al3++3OH-��֪��Ksp=c��Al3+����c��OH-��3=1��10-5��a3=1��10-32��a=1��10-9mol/L������ҺPH����СֵΪ5��
�ʴ�Ϊ��5��
��6����TiCl4��ϵ��Ϊ1������Ԫ���غ㣬TiO2•xH2O��ϵ��Ϊ1��HCl��ϵ��Ϊ4���ٸ���OԪ���غ㣬��֪H2O��ϵ��Ϊ��2+x������Ӧ�Ļ�ѧ����ʽΪ��TiCl4+��x+2��H2O=TiO2•xH2O��+4HCl��
�ʴ�Ϊ��TiCl4+��x+2��H2O=TiO2•xH2O��+4HCl��
��7��Fe3+��Ti3+��Ӧ������Fe2+��Ti4+������KSCN���Ժ�ɫ�����ﵽ�ζ��յ�ʱ���ټ���NH4Fe��SO4��2��Һ��Fe3+��������SCN-����Ѫ��ɫ��Fe��SCN��3��
�ʴ�Ϊ���������һ�α�Һ����ƿ����Һ����ɫ��Ϊ��Ѫ����ɫ���Ұ���Ӳ���ɫ��
��8��Fe3+��Ti3+��Ӧ������Fe2+��Ti4+�����ݵ�ʧ�����غ㣬��n��Ti3+����1=n��Fe3+����1����n��Fe3+��=n��Ti3+��=n��TiO2��=cV��10-3mol������������Ϊ $\frac{cV��1{0}^{-3}M}{w}$��100%=$\frac{cvM}{10w}%$��
�ʴ�Ϊ��$\frac{cvM}{10w}%$��
���� ���⿼������к͵ζ��Լ�������ԭ�ζ�����ȷ�ζ�����������ԭ���������������ǽ���Ĺؼ���������ؿ���ѧ���ķ�����������������ѧʵ�顢��ѧ�����������ۺ��Խ�ǿ��


 ��ʦ�㲦��ϵ�д�
��ʦ�㲦��ϵ�д� Ӣ�żƻ���ĩ����ϵ�д�
Ӣ�żƻ���ĩ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
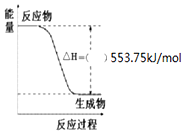 ��Ҫ��д��298K��101kPaʱ���з�Ӧ���Ȼ�ѧ����ʽ��
��Ҫ��д��298K��101kPaʱ���з�Ӧ���Ȼ�ѧ����ʽ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

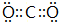 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
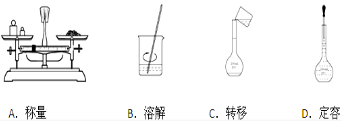
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | BrCl�Ļ�ѧ���ʺ�Cl2���ƣ�Cl2��ˮ��Ӧ��������ԭ��Ӧ��BrCl+H2O=HCl+HBrOҲ��������ԭ��Ӧ | |
| B�� | �����������£�������������������ͭ��Ӧ����������Ҳ����������ͭ��Ӧ | |
| C�� | ������ʹ���Ը��������ɫ���ױ�Ҳ����ʹ���Ը��������ɫ | |
| D�� | CO2��SiO2��Ϊ���������CO2����NaOH��Һ��Ӧ��SiO2Ҳ����NaOH��Һ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
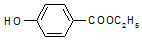 ������������ͼ��
������������ͼ��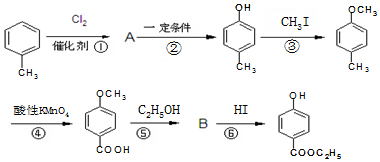
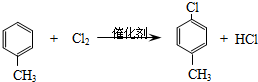 ��
�� ��-X��-YΪȡ�������Ƕ��ǻ�������������ͬ���칹�����ܷ���������Ӧ����-X�Ľṹ��ʽ������-OH��-CH2OH ��-OCH3��
��-X��-YΪȡ�������Ƕ��ǻ�������������ͬ���칹�����ܷ���������Ӧ����-X�Ľṹ��ʽ������-OH��-CH2OH ��-OCH3���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ǻ��ĵ���ʽ�� | B�� | ������ӵı���ģ�ͣ� | ||
| C�� | 1��3-����ϩ�ķ���ʽ��C4H8 | D�� | ��������Ľṹ��ʽ��C2H4O2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com