
【题目】图甲为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能。图乙为电解氯化铜溶液的实验装置的一部分。下列说法中正确的是

A. a极要与Y极连接
B. N电极发生还原反应,当N电极消耗5.6L(标准状况下)气体时,则a电极增重64g
C. 不论b为何种电极材料,b极的电极反应式一定为2C1--2e-=Cl2↑
D. 若有机废水中主要含有乙醛,则图甲中M极发生的电极应为:CH3CHO+3H2O-l0e-=2CO2↑+l0H+
【答案】D
【解析】
图甲中,M电极上有机物发生氧化反应,为电源负极,N电极上O2发生还原反应,为电源正极;图乙中,a极上Cu2+发生还原反应,连接电源负极,即X极,b极上Cl-发生氧化反应,连接电源正极,即Y极。
A.图甲中,X极为电源负极,Y极为电源正极;图乙中,a极上Cu2+发生还原反应,连接X极,b极上Cl-发生氧化反应,连接Y极,故A项错误;
B.理论上,N电极消耗5.6LO2(标准状况下)时,转移电子数为![]() ,又a极上发生反应Cu2++2e-== Cu,生成0.5mol Cu,质量为32g,故B项错误;
,又a极上发生反应Cu2++2e-== Cu,生成0.5mol Cu,质量为32g,故B项错误;
C.当b为活泼电极时,比如锌、铁、铜等,电极材料均会发生氧化反应,故C项错误;
D. 若有机废水中主要含有乙醛,则图甲中M极发生的电极应为:CH3CHO+3H2O-10e-=2CO2↑+l0H+,D项正确。
答案选D。


科目:高中化学 来源: 题型:
【题目】(1)如图1是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,则E1________(填“增大”、“减小”或“不变”,下同),ΔH________。请写出NO2和CO反应的热化学方程式:________________。
(2)观察图a和图b,根据盖斯定律,写出△H1、△H2、△H3、△H4、△H5和△H6的关系。图a:________________________;图b:_________________________。
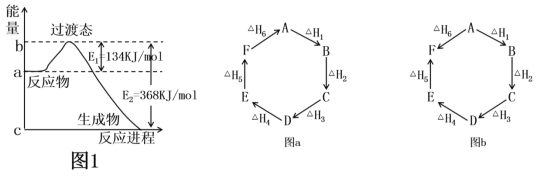
(3)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:① H2O(l)=H2O(g) △H=+44 kJ/mol
② 2N2(g)+CO2(g)+2H2O(g)=CH4(g)+4NO(g) △H= +1160 kJ/mol
③ CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H= -574 kJ/mol
请写出CH4(g)与NO2(g)反应生成参与大气循环的气体和液态水的热化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料PET聚酯树脂和PMMA的合成路线如下:

已知:Ⅰ.RCOOR′+ R′′18OH![]() RCO18OR′′+ R′OH(R、R′、R′′代表烃基);
RCO18OR′′+ R′OH(R、R′、R′′代表烃基);
Ⅱ.![]()
![]()
 (R、R′代表烃基);
(R、R′代表烃基);
(1)①的反应类型是______。
(2)②的化学方程式为______。
(3)PMMA单体的官能团名称是______、______。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为______。
(5)G的结构简式为______。
(6)下列说法正确的是______(填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.D的沸点比同碳原子数的烷烃高
d.1 mol 与足量NaOH溶液反应时,最多消耗4 molNaOH
与足量NaOH溶液反应时,最多消耗4 molNaOH
(7)J的某种同分异构体与J具有相同官能团,且为顺式结构,其结构简式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将![]() 体积NO和
体积NO和![]() 体积O2同时通入倒立于水中且盛满水的容器中,充分反应后,容器内残留
体积O2同时通入倒立于水中且盛满水的容器中,充分反应后,容器内残留![]() 体积的气体,该气体与空气接触变为红棕色,则
体积的气体,该气体与空气接触变为红棕色,则![]() 为( )
为( )
A. 3:2 B. 2:3 C. 8:3 D. 3:8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭烧瓶中,在25℃时存在如下平衡:2NO2(g)![]() N2O4(g) ΔH<0,将烧瓶置于100℃的水中,则下列几项性质中不会改变的是( )
N2O4(g) ΔH<0,将烧瓶置于100℃的水中,则下列几项性质中不会改变的是( )
①颜色 ②平均相对分子质量 ③质量 ④压强 ⑤密度
A.①和③B.③和⑤
C.④和⑤D.②和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较给出![]() 能力的相对强弱:
能力的相对强弱:![]() ________
________![]() (填“>”“<”或“=”);用一个化学方程式说明
(填“>”“<”或“=”);用一个化学方程式说明![]() 和
和![]() 结合
结合![]() 能力的相对强弱________。
能力的相对强弱________。
(2)![]() 是离子化合物,各原子均满足8电子稳定结构。写出
是离子化合物,各原子均满足8电子稳定结构。写出![]() 的电子式________。
的电子式________。
(3)在常压下,甲醇的沸点(65℃)比甲醛的沸点(-19℃)高。主要原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①![]() ;
;
②苯环上的取代基对新导入的取代基进入苯环的位置有显著的影响。如图表示以苯为原料制备一系列有机物的转化过程:
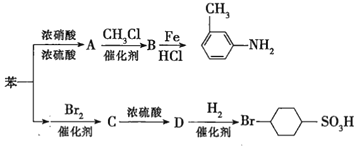
(1)![]() 是一种密度比水___________(填“大”或“小”)的无色液体,苯转化为
是一种密度比水___________(填“大”或“小”)的无色液体,苯转化为![]() 的化学方程式是______。
的化学方程式是______。
(2)在“苯![]() ”的转化过程中,属于取代反应的是______(填序号,下同),属于加成反应的是_________。
”的转化过程中,属于取代反应的是______(填序号,下同),属于加成反应的是_________。
(3)有机物![]() 苯环上的二氯代物有__________种结构;
苯环上的二氯代物有__________种结构;![]() 的所有原子____(填“在”或“不在”)同一平面上。
的所有原子____(填“在”或“不在”)同一平面上。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量稀盐酸加到下列固体混合物中,只能发生一种反应的是( )
A.NaOH、NaCl、NaAlO2B.KNO3、NaCl、CH3COONa
C.Na2S、(NH4)2SO3、AgNO3D.KNO3、Na2SO3、NH4HCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室欲用质量分数为36.5%的浓盐酸(密度为![]() )来配制
)来配制![]() 稀盐酸。请回答下列问题:
稀盐酸。请回答下列问题:
(1)需要用到的仪器除量筒烧杯外,还需用到的仪器有_________。
(2)在上述仪器选定的情况下,需要量取浓盐酸________![]() 。
。
(3)对于容量瓶来说除洗净外还必须进行的一项操作是_____________。
(4)配制溶液过程中,下列操作对溶液中溶质的物质的量浓度有何影响?(在横线上填“偏高”“偏低”或“无影响”)
①烧杯和玻璃棒洗净后没有烘干即进行实验:________________。
②溶解液转移后没有用蒸馏水洗涤烧杯2~3次:________________。
③定容时,俯视刻度线:__________________。
Ⅱ.取出配制好的盐酸![]() 与足量的锌粒反应。试计算:
与足量的锌粒反应。试计算:
(5)产生的氢气在标准状况下的体积为_________![]() 。
。
(6)转移的电子的物质的量为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com