
����˵����ȷ����
A���缫����ʽ��Cu-2e- = Cu2+�����ܷ�����ԭ����У����ܷ����ڵ�����
B��ij�¶��£�10mL 0.1mol/L��H2SO4��Һ��10mL 0.4 mol/L��KOH��Һ��Ϻ�pH=13
C������1mol H-H��N-H��N��N�������յ������ֱ�Ϊa kJ��b kJ��c kJ��
��2NH3( g) 3H2(g)��N2(g) ��H=(3a+c-6b) kJ/mol
3H2(g)��N2(g) ��H=(3a+c-6b) kJ/mol
D���к͵�����Ĵ�����Һ�����ĵ�pHֵ�İ�ˮ������������Һ������ֱ�ΪV1��V2����V1<V2
 ��ѧ��ʦ����ϵ�д�
��ѧ��ʦ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| ���� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 1mol CH3OCH3��1mol H2O | 2mol CH3OH | 1mol CH3OH |
| CH3OH��Ũ�ȣ�mol/L�� | c1 | c2 | c3 |
| ��Ӧ�������仯 | ����a kJ | �ų�b kJ | �ų�c kJ |
| ƽ��ʱ�����L�� | V1 | V2 | V3 |
| ��Ӧ��ת���� | �� 1 | �� 2 | �� 3 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
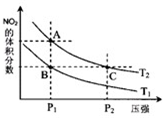 �ǽ���Ԫ�ص��ж����������NO��NO2��N2O4�ȣ�
�ǽ���Ԫ�ص��ж����������NO��NO2��N2O4�ȣ�| ʱ�䣨s�� | 0 | 20 | 40 | 60 | 80 |
| n��NO2��/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n��N2O4��/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
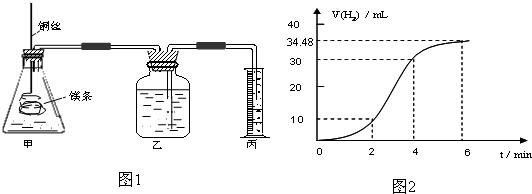
| ʵ���� | �� | �� | �� | �� |
| 10%H2O2�����/mL | 5.0 | 5.0 | V1 | V2 |
| 20%��������/mL | 0 | 0.5 | 1.0 | V3 |
| ˮ�����/mL | 15 | 14.5 | V4 | 13.5 |
| ����ʱ��t/s | t1 | t2 | t3 | t4 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com