
【题目】比亚迪公司开发了锂钒氧化物二次电池。电池总反应为V2O5+xLi![]() LixV2O5,下列说法正确的是
LixV2O5,下列说法正确的是
A.该电池充电时,锂电极与外加电源的负极相连
B.该电池放电时,Li+向负极移动
C.该电池充电时,阴极的反应为LixV2O5-xe-=V2O5+xLi+
D.若放电时转移0.2mol电子,则消耗锂的质量为1.4xg
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R五种元素的原子序数依次增大,只有X、Y、Z为短周期元素,相关信息如表:
元素 | 相关信息 |
X | 基态原子核外有3个能级,且各能级电子数目相等 |
Y | 常见化合价只有0、-1、-2 |
Z | 单质为黄绿色有毒气体 |
M | 第四周期d区元素,基态原子的核外有6个未成对电子 |
R | 第五周期,与X处于同一主族 |
(1)元素X、Y电负性的大小顺序是______(用元素符号表示)。
(2)XYZ2分子中所有原子均满足8电子构型,分子中σ键与π键的数目比为______。
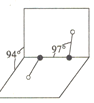
(3)元素Y可形成一种氢化物的空间结构如图所示,中心原子Y的杂化方式是______,该分子为______(填“极性”或“非极性”)分子。
(4)元素M基态原子的价电子排布式为______,MO5中M的化合价为+6价,则该分子中含有过氧键的数目为______。
(5)元素R与Z可形成化合物RZ2,用价层电子对互斥理论推断该分子的空间构型为______,分子中Z-R-Z的键角______120°(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)某有机物的结构简式为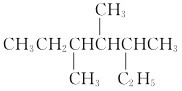
①该有机物系统命名法命名为____________ 。
②若该烷烃是由单炔烃和氢气加成得到的,则可能的单炔烃有________种。
③若该烷烃是由单烯烃和氢气加成得到的,则可能的烯烃有____种,任写一种烯烃的结构简式:________________________。
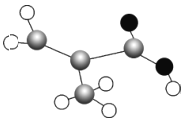
(2)某有机物只含C、H、O 三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等),该物质的结构简式为___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)101kPa下,1g氢气完全燃烧生成液态水放出142.9kJ热量,氢气的燃烧热△H =_______;氢气燃烧的热化学方程式为_______。
(2)某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
①倒入NaOH溶液的正确操作是________(填选项字母,下同)。
A.沿玻璃棒缓慢倒入
B.一次性迅速倒入
C.分三次少量倒入
②使硫酸与NaOH溶液混合均匀的正确操作是_______。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)工业合成氨反应为N2(g)+3H2(g)2NH3(g),一定条件下,在2 L密闭容器中进行实验,测得有关数据如下表所示:
物质 | N2(g) | H2(g) | NH3(g) |
起始(mol) | 2 | 7 | 0 |
10 s(mol) | 1.6 | ||
平衡时(mol) | 2 |
则010 s内,用氢气的浓度变化表示的平均反应速率是_______,该反应的化学平衡常数是_________。根据混合气体各成分的物质性质,你认为工业上将氨气从混合气体中分离出来的措施是_______ ,从而达到反应气体循环利用的目的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化锌(ZnCl2)可用作有机合成脱水剂、催化剂、缩合剂等。某实验小组在实验室采用HCl气体“置换”除水与ZnCl2升华相结合的方法从市售的氯化锌[含Zn(OH)Cl]制备高纯度无水氯化锌,装置如图所示。
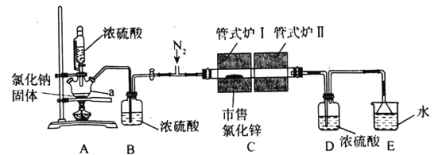
实验步骤:
①仪器连接完毕后,打开恒压滴液漏斗活塞,同时通入干燥纯净的N2。
②对管式炉I、管式炉II进行加热,管式炉I加热至150℃时开始反应,保持一段时间至置换除水完全再升温,继续升温约至550℃时不再有水蒸气蒸出。
③对管式炉I继续升温至770~800℃之间,至ZnCl2全部升华至管式炉II,停止加热管式炉I,并关闭恒压滴液漏斗活塞。
④继续通N2至尾气不再显酸性为止,在N2保护下将升华ZnCl2粉末分装在已知重量一端封闭的玻璃管中,用焊枪封口,称重,备用。
请回答下列问题:
(1)仪器a的名称为___,恒压滴液漏斗的作用为___。
(2)HCl气体“置换”除水的化学反应方程式为___。
(3)步骤②对管式炉II进行加热的目的为___。
(4)步骤②、③仍一直通入N2的目的分别为___、___。
(5)如无装置D,则会导致的后果为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用天然气作为制备甲醇CH3OH的原料。已知:
①CH4(g)+O2(g)CO(g)+H2(g)+H2O(g)△H=-321.5kJ/mol
②CH4(g)+H2O(g)CO(g)+3H2(g)△H=+250.3kJ/mol
③CO(g)+2H2(g)CH3OH(g)△H=-90kJ/mol
(1)CH4(g)与O2(g)反应生成CH3OH(g)的热化学方程式为______。
(2)向VL恒容密闭容器中充入a mol CO与2a molH2,在不同压强下合成甲醇。CO的平衡转化率与温度、压强的关系如图所示:

①压强P1______P2(填“<”、“>”或“=”)
②在100℃、P1压强时,平衡常数为______(用含a,V的代数式表示)。
(3)甲醇燃料电池往往采用KOH(或NaOH)浓溶液作电解质溶液,电极采用多孔石墨棒,两个电极上分别通入甲醇和氧气。通入氧气的电极为:通入甲醇的电极上发生的电极反应为:______。用此燃料电池电解某浓度氯化钠溶液,电解一段时间后,收集到标准状况下氢气3.36L,此时燃料电池所消耗的CH3OH的质量为:______。
(4)常温下,0.1mol/LNaHCO3溶液的pH大于8,则溶液中C(H2CO3)______C(CO32-)(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图

下列关于该高分子的说法正确的是
A. 完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境
B. 完全水解产物的单个分子中,含有官能团―COOH或―NH2
C. 氢键对该高分子的性能没有影响
D. 结构简式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用蒸馏水逐步稀释0.2mol/L的稀氨水时,若温度不变,在稀释过程下列数据始终保持增大趋势的是( )
A.c(OH-)B.c(NH4+)
C.![]() D.c(NH3·H2O)
D.c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氮(NH3、NH4+等)是一种重要污染物,可利用合适的氧化剂氧化去除。
(1)氯气与水反应产生的HClO可去除废水中含有的NH3。
已知:NH3(aq)+HClO(aq)=NH2Cl(aq)+H2O(l) ΔH=a kJ·mol-1
2NH2Cl(aq)+HClO(aq)=N2(g)+H2O(l)+3H+(aq)+3Cl-(aq) ΔH=b kJ·mol-1
则反应2NH3(aq)+3HClO(aq)=N2(g)+3H2O(l)+3H+(aq)+3Cl-(aq)的ΔH=________kJ·mol-1。
(2)在酸性废水中加入NaCl进行电解,阳极产生的HClO可氧化氨氮。电解过程中,废水中初始Cl-浓度对氨氮去除速率及能耗(处理一定量氨氮消耗的电能)的影响如图所示。
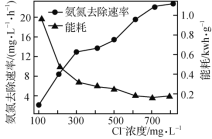
①写出电解时阳极的电极反应式:________________。
②当Cl-浓度减小时,氨氮去除速率下降,能耗却增加的原因是____________________________。
③保持加入NaCl的量不变,当废水的pH低于4时,氨氮去除速率也会降低的原因是____________________________。
(3)高铁酸钾(K2FeO4)是一种高效氧化剂,可用于氨氮处理。K2FeO4在干燥空气中和强碱性溶液中能稳定存在。氧化剂的氧化性受溶液中的H+浓度影响较大。
①碱性条件下K2FeO4可将水中的NH3转化为N2除去,该反应的离子方程式为________________________________。
②用K2FeO4氧化含氨氮废水,其他条件相同时,废水pH对氧化氨氮去除率及氧化时间的影响如图所示。当pH小于9时,随着pH的增大,氨氮去除率增大、氧化时间明显增长的原因是_________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com