
| һ������ױ� | 234�� | 206�� | 213.8�� | 204�� | 214.5�� | 205 |
| ��Ӧ�Ķ��ױ� | -13�� | -54�� | -27�� | -54�� | -27�� | -54�� |

 ��
�� ������һ�֣���
������һ�֣��� ���� ��1�����ױ�������ͬ���칹�壬�ֱ�Ϊ�Զ��ױ�������ױ����ڶ��ױ�����һ�����ֱ���1�֡�3�ֺ�2�֣����ݱ��ж�Ӧ���ױ����۵���жϣ��۵�Ϊ13��Ķ��ױ�ֻ��һ��һ�����۵�Ϊ-54��Ķ��ױ���3��һ�������۵�Ϊ-27��Ķ��ױ���2��һ��������۵�Ϊ13��Ķ��ױ��ǶԶ��ױ����۵�Ϊ-54��Ķ��ױ��Ǽ���ױ����۵�Ϊ-27��Ķ��ױ����ڶ��ױ���
��2��������CxHy�������ʵ�����ȣ���ȫȼ�պ�����ȡ���ڣ�x+$\frac{y}{4}$��ֵ����ֵԽ������Խ��������ͬʱ��������HԪ�ص���������Խ����ȫȼ��ʱ����O2Խ�ࣻ
��3����0.2molij��A����������ȫȼ�պ�����CO2��H2O��1.2mol����ԭ���غ��֪A�ķ���ʽΪC6H12��
����A����ʹ��ˮ��ɫ������һ��������������������ȡ����Ӧ����һ��ȡ����ֻ��һ�֣�����AΪ�����飻
������A��ʹ��ˮ��ɫ���ڴ��������£���H2�ӳɷ�Ӧ������2��2-�������飬��AΪCH2=CHC��CH3��3��
��4������ȼ��ͨʽ��֪��n+$\frac{2n-2}{4}$=8.5�����n=6���ʸ�������ʽΪC6H10�����ӽṹ��û��֧���������
�ٸ���Ϊ��״��ϩ��������������ʵ�����Br2�ӳɺ�ֻ�ܵõ���һ�����ö�ϩ��Ϊ�Գƽṹ����̼̼˫��������2��4λ����Ϊ1��5-����ϩ��
�ڸ���ֻ��������ʵ�����Br2�����ӳɷ�Ӧ�������ֻ��1��˫����ʣ�µIJ����Ͷ��dzɻ����£��ʻ�����һ������
��� �⣺��1�����ױ�������ͬ���칹�壬�ֱ�Ϊ�Զ��ױ�������ױ����ڶ��ױ�����һ�����ֱ���1�֡�3�ֺ�2�֣����ݱ��ж�Ӧ���ױ����۵���жϣ��۵�Ϊ13��Ķ��ױ�ֻ��һ��һ�����۵�Ϊ-54��Ķ��ױ���3��һ�������۵�Ϊ-27��Ķ��ױ���2��һ��������۵�Ϊ13��Ķ��ױ��ǶԶ��ױ����۵�Ϊ-54��Ķ��ױ��Ǽ���ױ����۵�Ϊ-27��Ķ��ױ����ڶ��ױ����۵�Ϊ234���һ����ױ�����Ӧ�Ķ��ױ���13��Ķ��ױ���������������֪���۵�Ϊ234���һ������ױ���Ӧ�����۵�Ϊ-13����ױ����Զ��ױ����Զ��ױ������ϵ�һ�����Ľṹ��ʽΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��2��ͬ��ͬѹͬ���ʱ��������CxHy�������ʵ�����ȣ���C3H8�ģ�x+$\frac{y}{4}$��=5��C2H4�ģ�x+$\frac{y}{4}$��=3��C4H8�ģ�x+$\frac{y}{4}$��=6��C6H14�ģ�x+$\frac{y}{4}$��=9.5����ȫȼ�պ�����ȡ���ڣ�x+$\frac{y}{4}$��ֵ����ֵԽ������Խ�࣬��ͬ��ͬѹͬ���ʱ����ȫȼ�պ�O2������С����C2H4��
��C3H8����C4H8����C2H4����C6H14��C��Hԭ����Ŀ֮�ȷֱ�Ϊ1��2.7��1��2��1��2��1��2.3������Ԫ��������������C3H8����C6H14����C4H8=��C2H4��������ͬʱ��������HԪ�ص���������Խ����ȫȼ��ʱ����O2Խ�࣬����ȫȼ��ʱ����O2����������C3H8��
�ʴ�Ϊ���ۣ��٣�
��3����0.2molij��A����������ȫȼ�պ�����CO2��H2O��1.2mol����ԭ���غ��֪A�ķ���ʽΪC6H12��
����A����ʹ��ˮ��ɫ������һ��������������������ȡ����Ӧ����һ��ȡ����ֻ��һ�֣�����AΪ�����飬�ṹ��ʽΪ�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
������A��ʹ��ˮ��ɫ���ڴ��������£���H2�ӳɷ�Ӧ������2��2-�������飬��AΪCH2=CHC��CH3��3������Ϊ��3��3-����-1-��ϩ��
�ʴ�Ϊ��3��3-����-1-��ϩ��
��4������ȼ��ͨʽ��֪��n+$\frac{2n-2}{4}$=8.5�����n=6���ʸ�������ʽΪC6H10�����ӽṹ��û��֧���������
�ٸ���Ϊ��״��ϩ��������������ʵ�����Br2�ӳɺ�ֻ�ܵõ���һ�����ö�ϩ��Ϊ�Գƽṹ����̼̼˫��������2��4λ����Ϊ1��5-����ϩ�������Ľṹ��ʽΪCH2=CH-CH2-CH2-CH=CH2��
�ʴ�Ϊ��CH2=CH-CH2-CH2-CH=CH2��
�ڸ���ֻ��������ʵ�����Br2�����ӳɷ�Ӧ�������ֻ��1��˫����ʣ�µIJ����Ͷ��dzɻ����£��ʻ�����һ�������ʸ����ĽṹΪ �ȣ�
�ȣ�
�ʴ�Ϊ�� ��
��
���� ���⿼���л�����ƶϡ�ͬ���칹�塢ϩ�������ʡ�ԭ�ӹ�������ȣ�ע����ݼ����ж��л���������ṹ�ص㣬��4�����л���Ľṹ�ж����ѵ㡢�״��㣬�Ѷ��еȣ�


 �Ƹ�С״Ԫͬ������������ϵ�д�
�Ƹ�С״Ԫͬ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1��1 | B�� | 2��1 | C�� | 1��2 | D�� | 4��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | һ�������£���N2������������N2�ķֽ��������ʱ���÷�Ӧ����ƽ��״̬ | |
| B�� | ȡ1mol N2��3mol H2�����ܱ������ڷ�Ӧ��ƽ��ʱ������2 mol NH3 | |
| C�� | һ�������·�Ӧ�ﵽƽ�⣬�ٳ���N2��������Ӧ���������淴Ӧ���ʼ�С | |
| D�� | һ�������·�Ӧ�ﵽƽ�⣬�������¶ȣ���Ӧ��������ƽ��������Ӧ�����ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ֻ�л��ý�������÷ǽ���֮����ܴ������Ӽ� | |
| B�� | ���н���Ԫ�ص�������һ���������Ӽ� | |
| C�� | ��ѧ���Ƿ����ж��ԭ��֮��ǿ�ҵ������ | |
| D�� | �������Ӽ��Ļ����������ӻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢۢܢ� | B�� | �ڢۢܢݢ� | C�� | �٢ڢܢݢ� | D�� | �٢ۢܢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
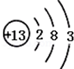 ������ͼ��ԭ�ӽṹʾ��ͼ�ش��������⣮
������ͼ��ԭ�ӽṹʾ��ͼ�ش��������⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
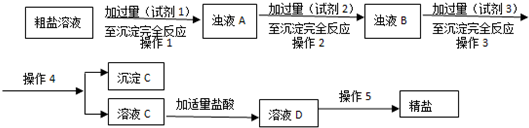
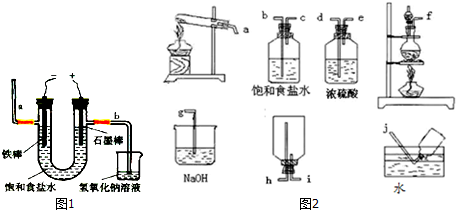
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com