
【题目】葡萄糖酸亚铁[(C6H11O7)2Fe]是医疗上常用的补铁剂,易溶于水,几乎不溶于乙醇。某实验小组同学拟用下图装置先制备FeCO3,再用FeCO3与葡萄糖酸反应进一步制得葡萄糖酸亚铁。
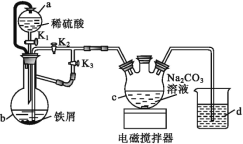
请回答下列问题:
(1)与普通漏斗比较,a漏斗的优点是___。
(2)按如图连接好装置,检査气密性后加入药品,打开K1和K3,关闭K2。
①b中的实验现象___。
②一段时间后,关闭___,打开___(选填“K1”“K2”或“K3”),观察到b中的溶液会流入c中,同时c中析出FeCO3沉淀。
③b中产生的气体的作用是___。
(3)将c中制得的碳酸亚铁在空气中过滤时间较长时,表面会变为红褐色,用化学方程式说明其原因:___。
(4)将葡萄糖酸与碳酸亚铁混合,须将溶液的pH调节至5.8,其原因是___。向上述溶液中加入乙醇即可析出产品,加入乙醇的目的是___。
(5)有同学提出用NaHCO3溶液代替Na2CO3溶液制得的碳酸亚铁纯度更高,其可能的原因是___。
【答案】平衡气压,利于稀硫酸顺利流下 铁屑溶解,溶液变为浅绿色,有大量气泡产生 K3 K2 排出装置内的空气,防止生成的FeCO3被氧化;把b中溶液压进c中 4FeCO3+O2+6H2O=4Fe(OH)3+4CO2 抑制Fe2+的水解 降低溶剂的极性,使晶体的溶解量减小更易析出 溶液的pH降低,减少氢氧化亚铁杂质的生成
【解析】
稀硫酸和Fe反应生成氢气,将装置中气体排出,防止亚铁离子被氧化;通过气体压强将b中硫酸亚铁排出,在三颈瓶中硫酸亚铁和碳酸钠反应生成碳酸亚铁,再用碳酸亚铁和葡萄糖酸反应生成葡萄糖酸亚铁。
(1)a为恒压滴液漏斗,可以保证内部压强不变,使漏斗内液体顺利流下;故答案为:平衡气压,利于稀硫酸顺利流下;
(2)①b中铁屑与稀硫酸反应,铁屑会逐渐溶解,溶液由于产生Fe2+变为浅绿色,并有大量气泡产生;故答案为:铁屑溶解,溶液变为浅绿色,有大量气泡产生;
②反应一段时间后,需要把FeSO4加到c中,所以需要关闭K3,打开K2,利用产生的气体把FeSO4压入到c中;故答案为: K3;K2;
③FeCO3易被氧化,b中反应产生的H2一是把装置内的空气排干净,防止生成的FeCO3被氧化;二是把b中溶液压进c中;故答案为:排出装置内的空气,防止生成的FeCO3被氧化,把b中溶液压进c中;
(3)过滤时间过长会发现产品部分变为红褐色,原因是FeCO3与O2及H2O反应生成Fe(OH)3,化学方程式为4FeCO3+O2+6H2O=4Fe(OH)3+4CO2;故答案为:4FeCO3+O2+6H2O=4Fe(OH)3+4CO2
(4)Fe2+易发生水解,将溶液的pH调节至5.8,可抑制Fe2+的水解;乙醇分子的极性比水小,可以降低葡萄糖酸亚铁在水中的溶解量,便于葡萄糖酸亚铁析出;故答案为:抑制Fe2+的水解;降低溶剂的极性,使晶体的溶解量减小更易析出;
(5)碳酸根离子水解后溶液碱性较强,易生成氢氧化亚铁,用NaHCO3溶液代替Na2CO3溶液可以降低溶液的pH,以免产生氢氧化亚铁,得到的产品纯度更高;故答案为:溶液的pH降低,减少氢氧化亚铁杂质的生成。


科目:高中化学 来源: 题型:
【题目】酯类物质M是一种药物的主要合成中间体,其合成路线如下:

已知以下信息:
①芳香烃A的相对分子质量在100~110之间,1molA完全燃烧可消耗10molO2。
②H的核磁共振氢谱显示其有3种氢。
③RCH=CH2![]() RCHClCH3
RCHClCH3
④RX+Mg![]() RMgX(X代表卤素)
RMgX(X代表卤素)
⑤
![]()


回答下列问题:
(1)A的结构简式为______,H中官能团的名称为______。
(2)由E和H生成M的化学方程式为______。
(3)属于氧化反应的是______(填序号)。
(4)同时符合下列条件的E的同分异构体有______种(不考虑立体异构),其中苯环上一氯代物只有两种的结构简式为______。(任写一种)
①能与碳酸钠溶液发生反应;②苯环上的取代基数目有2个
(5)请结合所给信息,由苯合成苯乙烯,合成路线如图所示,请回答下列问题。

试剂②为______,最后一步反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯和乙炔为原料合成化工原料E的路线如下:

回答下列问题:
(1)以下有关苯和乙炔的认识正确的是 ______
![]() 苯和乙炔都能使溴水褪色,前者为化学变化,后者为物理变化
苯和乙炔都能使溴水褪色,前者为化学变化,后者为物理变化
![]() 苯和乙炔在空气中燃烧都有浓烟产生
苯和乙炔在空气中燃烧都有浓烟产生
![]() 苯与浓硝酸混合,水浴加热55~60℃,生成硝基苯
苯与浓硝酸混合,水浴加热55~60℃,生成硝基苯
![]() 聚乙炔是一种有导电特性的高分子化合物
聚乙炔是一种有导电特性的高分子化合物
(2)A的名称 ______。
(3)生成B的化学方程式为 ______,反应类型是 ______。
(4)C的结构简式为 ______ ,C的分子中一定共面的碳原子最多有 ______ 个。
(5)与D同类别且有二个六元环结构(环与环之间用单键连接)的同分异构体有______种,请任写两种同分异构体的结构简式:______。
(6)参照上述合成路线,设计一条以乙炔和必要试剂合成环丙烷的路线: ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝试剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g)△H<0,若反应在恒容密闭容器中进行,如表由该反应相关图象作出的判断正确的是( )
N2O5(g)+O2(g)△H<0,若反应在恒容密闭容器中进行,如表由该反应相关图象作出的判断正确的是( )
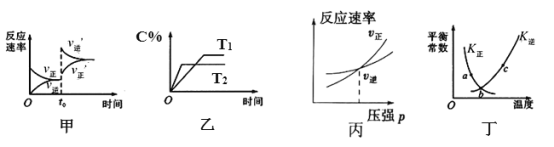
A.甲图中改变的反应条件为升温
B.乙图中温度T2>T1,纵坐标可代表NO2的百分含量
C.丙图为充入稀有气体时速率变化
D.丁图中a、b、c三点只有b点已经达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿是一种重要的铜矿石,主要含有硫化亚铜(Cu2S),还有Fe2O3、SiO2及一些不溶性杂质。一种以辉铜矿石为原料制备硝酸铜晶体的工艺流程如下:

已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
回答下列问题
(1)浸取后得到的浸出液中含有CuSO4、MnSO4。写出浸取时产生CuSO4、MnSO4反应的化学方程式__________。
(2)调节pH的目的是___________,pH的调节范围为___________。
(3)生成MnCO3沉淀的离子方程式为___________。
(4)操作A为___________。
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+3O2(g)═ 2Cu2O(s)+ 2SO2(g)△H=﹣768.2kJ/mol
2Cu2O(s)+ Cu2S(s)═ 6Cu(s)+ SO2(g)△H=" +116.0" kJ/mol
则由Cu2S与O2加热反应生成Cu的热化学方程式为___________。
(6)若用含85% Cu2S(Mr=160)的辉铜矿来制备无水Cu(NO3)2,假设浸取率为95%,调节pH时损Cu 3%,蒸氨过程中有5%未转化为CuO,其它过程中无损耗,则1.6 kg这样的辉铜矿最多能制备__________mol无水Cu(NO3)2。(计算结果精确到小数点后1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫是一种自然界分布较广的元素,在很多化合物中都含有该元素,回答下列问题:

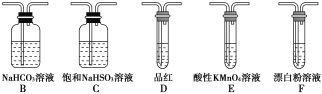
(1)装置A中反应的化学方程式为______________________________________。
(2)使分液漏斗中液体顺利流下的操作是_________________________。
(3)选用上面的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按照A→C→F的顺序连接装置即可证明,乙同学认为该方案不合理,其理由是_________
②丙同学设计的合理实验方案为A→C→________→________→D→F,其中装置C的作用是______,证明亚硫酸的酸性强于次氯酸的实验现象是____________
(4)K2S2O8具有强氧化性,可通过电解H2SO4和K2SO4的混合溶液制得,其阳极反应式为_________,称取0.250 0 g 产品于碘量瓶中,加100 mL水溶解,再加入8.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以淀粉为指示剂,用 c mol/L的Na2S2O3标准液滴定至终点,消耗Na2S2O3标准液V mL,则样品中K2S2O8的纯度为________%(用含c、V的代数式表示,已知:S2O82-+2I-===2SO42-+I2 ;2S2O32-+I2===2S4O82-+2I- )。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO),无色气体,易溶于水,有特殊的刺微气味,对人眼、鼻等有刺激作用。40%甲醛溶液沸点为96℃,易挥发。甲醛在碱性溶液中具有极强的还原性。为探究过量甲醛和新制Cu(OH)2反应的产物成分,进行如下研究:
(1)在下图装置中进行实验,向a中加入0.5mol·L-1CuSO4溶液50mL和5 mol·L-1 NaOH溶液100mL,振荡,再加入40%的甲醛溶液40mL,缓慢加热a,在65℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红色,并有气体产生。

①仪器b的名称是____________。
②仪器c的作用为____________。
③能说明甲醛具有还原性的实验现象是____________。
(2)查阅资料发现气体产物是副反应产生的。为确认气体产物中含H2不含CO,将装置A和如下图所示的装置连接后进行实验。

①依次连接的合理顺序为:A→B→_____→_____→_____→_____→G,________
②装置B的作用是_______________。
③确认气体产物中含H2而不含CO的现象是_________________________。
(3)已知:![]() 。证明a中甲醛的碳元素未被氧化成+4价的实验方案为:取少量a中反应后的清液,____________________,则说明甲醛的碳元素未被氧化成+4价。
。证明a中甲醛的碳元素未被氧化成+4价的实验方案为:取少量a中反应后的清液,____________________,则说明甲醛的碳元素未被氧化成+4价。
(4)为研究红色固体产物的组成,进行如下实验(以下每步均充分反应);

已知:ⅰ.Cu2O ![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色) ![]() [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)
ⅱ.2Cu+8NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O
通过上述实验,可以得出红色固体产物主要是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
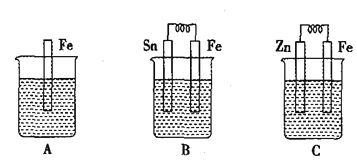
①B中Sn极的电极反应式为__________,Sn极附近溶液的pH_____(填“增大”、“减小”或“不变”)。
②C中总反应离子方程式为_____________,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是________。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:

①电池的负极是______(填“a”或“b”)电极,该极的电极反应是_______。
②电池工作一段时间后电解质溶液的pH____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com