
【题目】下列关于制取蒸馏水的实验装置与操作的说法中,不正确的是( )
A.可用过滤的方法制取蒸馏水
B.冷凝器中的水流方向是从下口进入,上口排出
C.实验中需要在蒸馏烧瓶中加入几片碎瓷片,防止出现暴沸现象
D.给蒸馏烧瓶加热时必须垫石棉网
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。
下列说法不正确的是( )
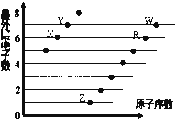
A. 氢化物沸点:H2X>HY>H2R B. 含氧酸酸性:HWO>H2RO4
C. 气态氢化物的稳定性:HY>HW>H2R D. 离子半径:R2->X2->Y->Z+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.在25℃时,将amol?L﹣1的氨水与0.01 mol?L﹣1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl﹣),用含a的代数式表示NH3?H2O的电离常数:Kb= ![]()
B.在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应生成Z,平衡后测得X、Y的转化率与起始时两物质的物质的量之比n(X)/n(Y>的关系如图所示,则x与Y的反应方程式可表示为:X+3Y?nZ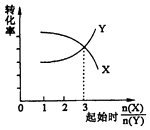
C.某同学在实验室进行了如图所示的实验,则Y中反应的离子方程式为:3CaCO3+2Fe3++3H2O═2Fe(OH)3+3CO2↑+3Ca2+
D.将10mL 1 mol?L﹣1Na2CO3溶液逐滴滴加到10mL1mol?L﹣1盐酸中,滴加结束后生成的溶液中有:C(Na+)>c(Cl﹣)>c(CO32﹣)>c(HCO3﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大. I2在KI溶液中存在下列平衡:I2(aq)+I﹣(aq)I3﹣(aq).测得不同温度下该反应的平衡常数如图所示,下列说法正确的是( ) 
A.反应I2(aq)+I﹣(aq)I3﹣(aq)的△H>0
B.利用该反应可以除去硫粉中少量的碘单质
C.在上述平衡体系中加入苯,平衡不移动
D.25℃时,在上述平衡体系中加入少量KI固体,平衡常数K小于680
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于2molSO2的叙述中,正确的是( )
A.体积为44.8 LB.含有4mol氧原子
C.分子数为6.02×1023D.摩尔质量为128 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学活动小组利用以下装置,制备LiH固体。
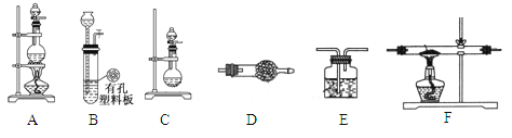
(1)元素锂在周期表中的位置 __________________。
(2)在LiH固体中比较离子半径大小关系r(Li+) _________r(H-)。(填“>”或“<”)
(3)活动小组准备利用上述部分装置制备LiH固体。可选用的药品有:金属锂、锌粒、稀盐酸、浓硫酸、碱石灰。已知:氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能够引起燃烧。设计实验方案如下:
①仪器装置连接顺序为B→D→F→E,加入药品前首先要进行的实验操作是___________________(不必写出具体的操作方法);加入药品后,其中装置D的作用是____________________________。
②通入一段时间氢气后加热石英管,在加热F处的石英管之前,必须进行的实验操作是_______________________________。
③加热一段时间后停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处。采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险。完成LiH与水反应的化学方程式___________________________________。
④准确称量制得的产品0.11g,在一定条件下与足量水反应后,共收集到气体291.2 mL(已换算成标准状况),则产品中LiH与Li的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)30%的H2SO4和50%的H2SO4等质量混合后,所得溶液的质量分数(填“大于”、“小于”或“等于”)40%,如果等体积混合,混合后溶液的质量分数(填“大于”、“小于”或“等于”)40%.
(2)已知98%的浓H2SO4的物质的量浓度为18.4molL﹣1 , 试判断49%的H2SO4的物质的量浓度(填“大于”、“小于”或“等于”)9.2molL﹣1 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com