

分析 氯酸钠、水和稀硫酸在ClO2发生器中通入二氧化硫和空气反应生成ClO2 ,吸收塔内的反应是氢氧化钠、过氧化氢吸收ClO2 反应生成亚氯酸钠(NaClO2),蒸发浓缩结晶析出,过滤洗涤得到晶体,
(1)发生器中发生反应为氯酸钠在酸溶液中氧化二氧化硫生成二氧化氯和硫酸,由信息②可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.据此解答.
(2)根据题目信息并运用氧化还原反应理论判断反应物、生成物.根据流程信息可知,吸收塔内生成NaClO2,一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生.据此书写方程式.温度过高,H2O2容易分解;
(3)还原性要适中.还原性太强,会将ClO2还原为更低价态产物,影响NaClO2生产;方便后续分离提纯,加入试剂不能干扰后续生产,Na2O2溶于水相当于H2O2.(4)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体.得到的粗晶体经过重结晶可得到纯度更高的晶体;
(5)①步骤Ⅱ中发生反应是酸性溶液中ClO2-能被I-完全还原成Cl-,碘离子被氧化为碘单质,溶液中Na2S2O3能与I2反应:2Na2S2O3+I2=2NaI+Na2S4O6.溶液颜色蓝色变化为无色分析判断反应终点;
②依据ClO2-+4H++4I-=2I2+Cl-+2H2O,2Na2S2O3+I2=2NaI+Na2S4O6,反应的定量关系计算得到;
解答 解:(1)发生器中发生反应是氯酸钠在酸溶液中氧化二氧化硫生成二氧化氯和硫酸,反应的离子方程式为:2ClO3-+SO2=2ClO2↑+SO42-,由信息②可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.发生器中鼓入空气的作用应是稀释ClO2以防止爆炸,故选c,
故答案为:2ClO3-+SO2=2ClO2↑+SO42-,c;
(2)根据流程信息可知,吸收塔内生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应方程式为2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2,H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能超过20℃,其目的是防止H2O2分解,
故答案为:2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2;防止H2O2分解.
(4)还原性要适中.还原性太强,会将ClO2还原为更低价态产物,影响NaClO2生产;方便后续分离提纯,加入试剂不能干扰后续生产.Na2O2溶于水相当于H2O2.Na2S、FeCl2还原性较强,生成物与NaClO2分离比较困难,故选a,
故答案为:a;
(4)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体,得到的粗晶体经过重结晶可得到纯度更高的晶体,
故答案为:蒸发浓缩、冷却结晶、过滤;
(5)①步骤Ⅱ中发生反应是酸性溶液中ClO2-能被I-完全还原成Cl-,碘离子被氧化为碘单质,离子方程式为:ClO2-+4H++4I-=2I2+Cl-+2H2O,溶液中Na2S2O3能与I2反应:2Na2S2O3+I2=2NaI+Na2S4O6.溶液颜色蓝色变化为无色分析判断反应终点,滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化,
故答案为:滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化;
②依据ClO2-+4H++4I-=2I2+Cl-+2H2O,2Na2S2O3+I2=2NaI+Na2S4O6,反应的定量关系计算得到,设NaClO2物质的量为x,
ClO2-~2I2~4Na2S2O3+
1 4
x cV×10-3mol
x=$\frac{cV×1{0}^{-3}}{4}$mol
样品中NaClO2的质量分数=$\frac{\frac{cV×1{0}^{-3}}{4}×\frac{250}{25}×90.5g/mol}{mg}$×100%=$\frac{22.625cV}{m}%$,
故答案为:$\frac{22.625cV}{m}%$;
点评 本题以学生比较陌生的亚氯酸钠制备为背景,以过氧化氢法制备亚氯酸钠为主线,考察学生阅读题目获取信息的能力、对浓度概念的理解、对氧化还原反应相关知识的运用、有关实验操作和简单实验设计能力考察以及在新情境下综合运用知识解决问题的能力.题目有一定的难度.


科目:高中化学 来源: 题型:选择题
| A. | 氢气和氯气反应生成氯化氢气体的热化学方程式是:H2(g)+Cl2(g)=2HCl(g) | |
| B. | 氢气和氯气反应生成2mol氯化氢气体,反应的△H=+183KJ•mol-1 | |
| C. | 氢气和氯气反应生成2mol氯化氢气体,反应的△H=-183KJ•mol-1 | |
| D. | 氢气和氯气反应生成1mol氯化氢气体,反应的△H=+183KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15mol/L | B. | 0.20mol/L | C. | 0.225mol/L | D. | 0.30mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
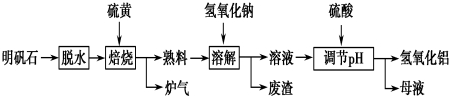
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
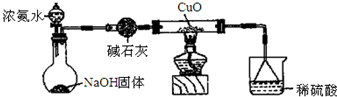
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中KMnO4被氧化 | |
| B. | 反应中得到电子的物质是Cl2 | |
| C. | 每生成1 mol Cl2时,反应中转移的电子为2 mol | |
| D. | 被还原的HCl占参加反应HCl物质的量的3/8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 | |
| B. | 三者的单质放置在空气中均只生成氧化物 | |
| C. | 工业上,三者的单质目前都使用热还原法制得 | |
| D. | 电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl | ||
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | D. | 2C6H6+15O2$\stackrel{点燃}{→}$12CO2+6H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com