
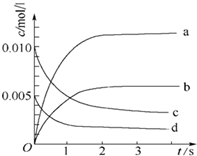
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
分析 (1)由表中数据可知从3s开始,NO的物质的量为0.007mol,不再变化,3s时反应达平衡;
(2)NO2是产物,随反应进行浓度增大,平衡时浓度为NO浓度的变化量△c(NO);根据v=$\frac{△c}{△t}$计算v(NO),再利用速率之比等于化学计量数之比计算v(O2);
(3)可逆反应达到平衡时,v正=V逆 (同种物质表示)或正逆速率之比等于化学计量数之比(不同物质表示),反应混合物各组分的物质的量、浓度、含量不再变化,以及由此衍生的一些量也不发生变化,由此进行判断;
(4)增大反应速率的措施有增加浓度,升高温度,增大压强,加催化剂;
(5)根据转化率=$\frac{转化量}{起始量}$×100%计算.
解答 解:(1)由表中数据可知从3s开始,NO的物质的量为0.007mol,不再变化,3s时反应达平衡,所以平衡时NO的浓度为$\frac{0.007mol}{2L}$=0.0035mol/L
故答案为:0.0035mol/L
(2)NO2是产物,随反应进行浓度增大,到达平衡时浓度为NO浓度的变化量△c(NO)=$\frac{0.02mol-0.007mol}{2L}$=0.0065mol/L,所以图中表示NO2变化的曲线是b;2s内用NO表示的平均反应速率v(NO)=$\frac{(0.02mol-0.008mol)÷2L}{2s}$=3.0×10-3mol•L-1•s-1,速率之比等于化学计量数之比,所以v(O2)=$\frac{1}{2}$v(NO)=$\frac{1}{2}$×3.0×10-3mol•L-1•s-1=1.5×10-3mol•L-1•s-1
故答案为:b 1.5×10-3mol•L-1•s-1
(3)a、表示同一方向反应速率,v(NO2)自始至终为v(O2)的2倍,不能说明达到平衡,故a错误;
b、随反应进行,反应混合气体总的物质的量在减小,气体总物质的量保持不变,说明反应到达平衡,故b正确;
c、不同物质表示速率,到达平衡时,正逆速率之比等于化学计量数之比,V逆 (NO):正(O2)=2:1,即V逆 (NO)=2v正(O2),故c正确;
d、混合气体的总质量不变,容器容积为定值,所以密度自始至终不变,不能说明达到平衡,故d错误.
故答案为:b c
(4)升高温度,增大压强,使用催化剂可使反应速率加快,分离出产物二氧化氮,反应正向移动,但反应速率减小,a错误;
故答案为:bcd
(5)NO的转化率为:$\frac{转化量}{起始量}$×100%=$\frac{0.02-0.007}{0.02}$×100%=0.65=65%;
故答案为:65%.
点评 本题主要考查反应速率、转化率、平衡平衡状态的判断及读图表能力,难度中等,判断平衡时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 加适量水 | B. | 通HCl气体 | C. | 加NaOH固体 | D. | 加MgSO4 固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
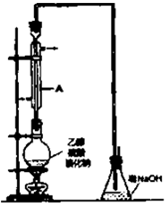 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式是CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O.
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式是CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu+H2O $\frac{\underline{\;电解\;}}{\;}$ Cu2O+H2↑. |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物进行相互反应,生成无毒物质;或者使用新型燃料电池作汽车动力,减少汽车尾气污染.
汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物进行相互反应,生成无毒物质;或者使用新型燃料电池作汽车动力,减少汽车尾气污染.
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| c (NO)(×10-3 mol•L-1) | 1.00 | 0.50 | 0.20 | 0.10 | 0.10 |
| c (CO)(×10-3 mol•L-1) | 3.00 | 2.50 | 2.20 | 2.10 | 2.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g H2 | B. | 2molCl2 | C. | 1.5NACO2 | D. | 22.4LO2(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>Z>Y | B. | Z>X>Y | C. | X>Y>Z | D. | Y>Z>X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com