
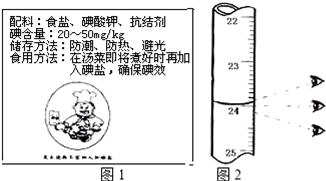
| 编号 | 碱式滴定管读数 | 消耗体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 0 | 如图一 | |
| 2 | 0 | 23.97 | 23.97 |
| 3 | 0 | 24.03 | 24.03 |
分析 Ⅰ根据碘盐碘元素含量为50mg/kg,成人推荐服用量为100mg碘进行计算;根据计算出的碘盐的量进行判断合理性;
Ⅱ(1)根据滴定管的正确读数方法完成,注意读到0.01mL;
(2)根据滴定终点时溶液的颜色变化且半分钟不褪色完成;
(3)根据表中数据计算出消耗的硫代硫酸钠溶液的平均体积,再计算出硫代硫酸钠的物质的量了,根据关系式KIO3~3I2~6Na2S2O3计算出碘酸钾的物质的量,最后计算出1Kg碘盐中碘含量;
(4)A、砝码、药品放颠倒,称量的质量减小,配制的标准液浓度减小;
B、导致待测液的物质的量减小,消耗的标准液体积减小;
C、未润洗会标准液的体积减小,滴定时消耗的标准液体积减小;
D、滴定前有气泡,导致消耗的标准液体积偏大.
解答 解:I由于成人推荐服用量为100mg碘,碘盐碘元素含量为50mg/kg,所以要达到上述碘含量要求,需服用该碘盐的质量是:$\frac{100mg}{50mg/kg}$=2Kg,24小时内不可能服用2Kg碘盐,所以不合理,
故答案为:2;不合理;
II.(1)读数时眼睛要平视滴定管内的液面,并且读到0.01mL,图中读数是:24.00,
故答案为:24.00;
(2)反应没有结束前溶液显示蓝色,反应结束时碘消失,溶液蓝色褪去,所以滴定终点的现象是:溶液颜色恰好由蓝色变为无色且半分钟内不褪色,
故答案是:溶液颜色恰好由蓝色变为无色且半分钟内不褪色;
(3):三次滴定消耗的标准液体积都是有效的,平均体积是:$\frac{24.00+23.97+24.03}{3}$mL=24mL,消耗的硫代硫酸钠的物质的量是:n(Na2S2O3)=0.024L×bmol•L-1=0.024bmol,
根据反应:①KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O、②I2+2Na2S2O3=2NaI+Na2S4O6(无色),可得关系式:KIO3~3I2~6Na2S2O3,
n(I)=n(KIO3)=$\frac{1}{6}$n(Na2S2O3)=$\frac{1}{6}$×0.024bmol=0.004bmol,1Kg碘盐中碘含量是:$\frac{0.004b×127×1000}{a}$g/Kg=$\frac{508000b}{a}$mg/kg,
故答案为:$\frac{508000b}{a}$;
(4)A、步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g,药品、砝码放颠倒,称量的质量减小,配制的待测液物质的量减小,测定结果偏低,故A错误;
B、步骤1所配食盐溶液未完全转移至锥形瓶,导致待测液物质的量减小,测定结果偏低,故B错误;
C、步骤2中滴定管洗涤后未润洗,标准液没有润洗,导致标准液浓度减小,滴定时消耗的标准液体积偏大,测定结果偏高,故C正确;
D、步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失,导致消耗的标准液体积偏大,测定结果偏大,故D正确;
故答案为:CD.
点评 本题考查了碘盐中碘含量的测定,涉及的内容较多,充分考查了学生的综合分析、理解能力,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 10个 | B. | 20个 | C. | 40个 | D. | 80 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀H2SO4 | B. | C2H5OH | C. | 稀HNO3 | D. | CH 3COOH(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com