
| A、pH=4 |
| B、[H+]=1×10-3mol?L-1 |
| C、[OH-]=1×10-12mol?L-1 |
| D、[OH-]=1×10-14mol?L-1 |
| 10-14 |
| 10-12 |
| 10-14 |
| 10-14 |


科目:高中化学 来源: 题型:
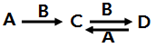 短周期主族元素X、Y、Z、W、M、N 的原子序数依次增大,且原子最外层电子数之和为23.X的原子半径比Y的小,X与W同主族,Z的最外层电子数是电子层数的3倍,M是地壳中含量最高的金属元素.
短周期主族元素X、Y、Z、W、M、N 的原子序数依次增大,且原子最外层电子数之和为23.X的原子半径比Y的小,X与W同主族,Z的最外层电子数是电子层数的3倍,M是地壳中含量最高的金属元素.查看答案和解析>>
科目:高中化学 来源: 题型:
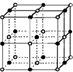 完成下列问题.
完成下列问题.| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ?mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应物的总能量一定高于生成物的总能量 |
| B、铝与氧化铁反应既是氧化还原反应,又是吸热反应 |
| C、化学反应中发生能量变化的根本原因是化学键的断裂与形成 |
| D、同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学生设计了如图的方法对X盐进行鉴定:由此分析,下列结论中不正确的是( )
某学生设计了如图的方法对X盐进行鉴定:由此分析,下列结论中不正确的是( )| A、X中可以有Fe2+ |
| B、Y为AgI沉淀 |
| C、X中可以有Fe3+ |
| D、M试剂可以是H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在HCN中,碳、氮原子均进行sp2杂化,每个分子有2个σ键和2个π键 |
| B、金刚石的人工合成,既可以高压合成,也可以低压合成 |
| C、碳元素基态原子的核外电子排布式为1s22s22p6,6个电子分占3个原子轨道 |
| D、含有碳元素的晶体有原子晶体、分子晶体及混合晶体,但没有离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
| B、HClO是弱酸,所以NaC1O是弱电解质 |
| C、HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
| D、工业上电解NaCl溶液得到22.4L H2(标准状况),理论上需转移NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2SO4 |
| B、AgNO3 |
| C、NaCl |
| D、AlCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com