
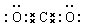 (3)
(3)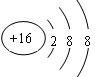 (4)强
(4)强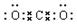 。
。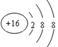 。
。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源:不详 题型:单选题
| A.Px轨道上有3个电子 | B.第三电子层Px轨道有3个伸展方向 |
| C.Px电子云有3个伸展方向 | D.第三电子层沿x轴方向伸展的p轨道 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径C>D>A>B | B.原子序数b<a<c<d |
| C.离子半径D>C>A>B | D.单质的还原性A>B>C>D |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.它处于元素周期表中第二周期VA族 |
| B.它的最高正价为+5,负价为-3 |
| C.它的最高价氧化物对应水化物是一种强酸 |
| D.它的非金属性比磷弱比氧强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2Na2SiO3+CaSiO3+3CO2↑
2Na2SiO3+CaSiO3+3CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com