
人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
[配制KMnO4标准溶液]如图是配制50 mL KMnO4标准溶液的过程示意图。

(1)请你观察图示判断,其中不正确的操作有(填序号)__________;
(2)其中确定50 mL溶液体积的容器是(填名称)__________;
(3)如果用图示的操作所配制的溶液进行实验,在其他操作正确的情况下,所配制的溶液浓度将____________(填“偏大”或“偏小”)。
[测定血液样品中Ca2+的浓度] 抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)已知草酸跟KMnO4反应的离子方程式为:
2MnO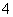 +5H2C2O4+6H+===2Mnx++10CO2↑+8H2O
+5H2C2O4+6H+===2Mnx++10CO2↑+8H2O
则方程式中的x=________。
(5)经过计算,血液样品中Ca2+的浓度为________ mg/cm3。
科目:高中化学 来源: 题型:
化学用语在化学学科中作用非常重要,以下有关化学用语描述正确的是:
A.Mg2+的结构示意图: B.Na2S的电子式:
B.Na2S的电子式: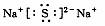
C.氨气的空间结构:三角形 D.乙烯的结构简式:(CH2)2
查看答案和解析>>
科目:高中化学 来源: 题型:
V L Fe2(SO4)3溶液中含有a g SO ,取此溶液0.5V L,用水稀释至2V L,则稀释后溶液中Fe3+的物质的量的浓度为( )
,取此溶液0.5V L,用水稀释至2V L,则稀释后溶液中Fe3+的物质的量的浓度为( )
A. mol/L B.
mol/L B. mol/L
mol/L
C. mol/L D.
mol/L D. mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列目的能达到的是( )
A.将58.5 g NaCl溶于1 L水中可得1 mol/L的NaCl溶液
B.将标准状况下22.4 L HCl溶于1 L水中可得1 mol/L盐酸
C .将25.0 g胆矾溶于水后配成100 mL溶液所得溶液浓度为1 mol/L
.将25.0 g胆矾溶于水后配成100 mL溶液所得溶液浓度为1 mol/L
D.将78 g Na2O2溶于水,配成1 L溶液可得到浓度为2 mol/L溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
最近科学家冶炼出了纯度高达99.999 9%的铁,据你推测,下列性质它不可能具有的是( )
A、硬度比生铁低
B、在潮湿空气中放置不易生锈
C、在冷的浓硫酸中可钝化
D、与4 mol·L-1盐酸反应的速率比生铁快
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于氧化物的叙述中不正确的是( )
①酸性氧化物均可与水反应生成相应的酸 ②非金属氧化物肯定是酸性氧化物 ③碱性氧化物肯定是金属氧化物 ④金属氧化物都是碱性氧化物 ⑤不能跟酸反应的氧化物一定能跟碱反应
A.①②④⑤ B.①②③④⑤
C.②③④ D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。

Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3(aq)+S(s) Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是__________________________。
(2)仪器a的名称是________,其作用是____________________。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是______________。检验是否存在该杂质的方法是____________________________。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:________________________________________________________________________
________________________________________________________________________。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为2S2O +I2===S4O
+I2===S4O +2I-
+2I-
(5)滴定至终点时,溶液颜色的变化:____________________________________________。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为__________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。

Ⅲ.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO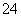 ,常用作脱氯剂,该反应的离子方程式为____________________________________________。
,常用作脱氯剂,该反应的离子方程式为____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com