
 硝基胍是硝化纤维火药、硝化甘油火药的掺合剂、固体火箭推进剂的重要组分,其结构如图所示(“→”是一种特殊的共价单键).下列有关硝基胍的说法正确的是( )
硝基胍是硝化纤维火药、硝化甘油火药的掺合剂、固体火箭推进剂的重要组分,其结构如图所示(“→”是一种特殊的共价单键).下列有关硝基胍的说法正确的是( )| A. | 硝基胍分子中只含极性键,不含非极性键 | |
| B. | 硝基胍中有C、H、O、N四种元素,属于氨基酸 | |
| C. | 硝基胍分子中σ键与π键的个数比是5:1 | |
| D. | 10.4 g该物质含有1.1×6.02×1023个原子 |
分析 硝基胍中含C元素为有机物的硝化产物,分子中含有C=N、N=O、C-N、N-N以及N→O键等,结合有机物的构成解答该题.
解答 解:A.分子中N-N为非极性键,故A错误;
B.分子中含有氨基,但不含羧基,不是氨基酸,故B错误;
C.分子中含有4个N-H键,1个C=N键,1个N=O键,2个C-N键,1个N-N键和1个N→O键,σ键与π键的个数比是5:1,故C正确;
D.分子式为CN4H4O2,相对分子质量为104,10.4 g该物质的物质的量为0.1mol,1.1×6.02×1023个原子,故D正确.
故选CD.
点评 本题考查共价键及有机物的结构与性质,把握分子的构成及化学键为解答本题的关键,注意物质中含氧元素,侧重学生能力的考查,选项C为解答的难点,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应Ⅰ:恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ:绝热恒容 | 0min | 0 | 0 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可使用溴水鉴别植物油和汽油 | |
| B. | 利用二氧化碳制造全降解塑料,可以消除温室效应 | |
| C. | “玉兔号”月球车上的太阳能电池的材料是硅 | |
| D. | 实验室金属钠失火时,可使用泡沫灭火器灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,对该有机物下列叙述正确的是( )
,对该有机物下列叙述正确的是( )| A. | 该有机物易溶于水 | |
| B. | 不能使酸性KMnO4溶液褪色 | |
| C. | 在加热和催化剂作用下,1mol该有机物最多能和4 mol H2反应 | |
| D. | 一定条件下,能和NaOH醇溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
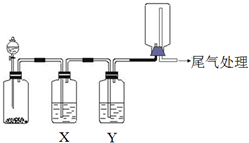
| 选项 | 实验目的 | X中试剂 | Y中 试剂 |
| A | 粗锌与稀盐酸制取 收集干燥的氢气 | 饱和食盐水 | 浓硫酸 |
| B | Na2SO3固体与较浓盐酸 反应制取收集干燥SO2 | 饱和Na2SO3溶液 | 浓硫酸 |
| C | 铜与稀硝酸制取并收集 纯净干燥的NO | 水 | 浓硫酸 |
| D | CaCO3和稀盐酸制取收集 纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 和
和 ; ⑧尿素【CO(NH2)2】和 氰酸铵(NH4CNO)
; ⑧尿素【CO(NH2)2】和 氰酸铵(NH4CNO)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-+H2O?H3O++CO32- | B. | ClO-+H3O+?HClO+H2O | ||
| C. | HS-+H2O?H2S+OH- | D. | NH4++OH-?NH3•H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com