
【题目】下列各组数据中,前者刚好是后者两倍的是( )
A.200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
B.2 molCO的摩尔质量和1 mol CO的摩尔质量
C.64 g二氧化硫中氧原子数和标准状况下22.4 LCO中氧原子数
D.20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
科目:高中化学 来源: 题型:
【题目】生产生活中常用84消毒液杀菌消毒。化学课外小组用Cl2和NaOH固体、水制取84消毒液。请回答下列问题:
(1)实验室制取Cl2的化学方程式为________,收集Cl2应使用_____法,要得到干燥的Cl2可选用_____作干燥剂,标准状况下,4.48LCl2的物质的量为______mol。
(2)制取84消毒液需要4.0mol·L-1的NaOH溶液100mL,配制时称量NaOH固体的质量为_____g,配制过程中使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、_______。
(3)制取84消毒液的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)欲使3mol的VO2+变为VO2+,则需要氧化剂KClO3的物质的量为____mol(已知:KClO3被还原成KCl)。
(2)向200mL0.1mo/L 的Fe(NO3)2溶液中加入适量的NaOH 溶液,使Fe2+恰好完全沉淀,过滤,小心加热沉淀,直到水分蒸干,再灼烧后得到固体的质量为___g。
(3)将0.51g的Mg、Al混合物溶于500mL,4mol/L HCl,加入2mol/L NaOH,要使沉淀的量达到最大值,则加入NaOH的量最少为___mL。
(4)200℃时CO2和水蒸气的混合气体共23.2g与足量的Na2O2充分反应后,固体质量增大了7.2g,则原混合气体的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所选装置或实验设计合理的是
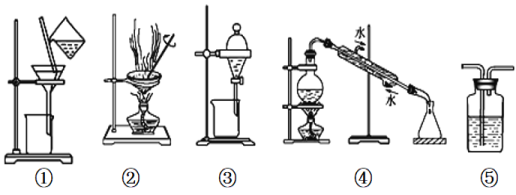
A. 用图①和②所示装置可以除去Na2CO3中的CaCO3杂质,并获得Na2CO3固体
B. 用乙醇提取溴水中的溴选择图③所示装置
C. 用图④所示装置可以分离乙醇水溶液
D. 图⑤所示装置中盛有饱和Na2CO3溶液除去CO2中含有的少量HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组加入相应试剂后,发生反应的离子方程式正确的是( )
离子组 | 加入试剂 | 离子方程式 | |
A | Na+、 | Ba(OH)2溶液 | 2Na++ |
B | H+、Cl- | 足量石灰乳 | 2H++2OH-=2H2O |
C | K+、 | NaHSO4溶液 |
|
D | Ag+、 | 少量盐酸 | Ag++ |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7是一种强氧化剂,在酸性条件下与乙醇发生如下反应: 3CH3CH2OH+2K2Cr2O7+8H2SO4=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O

(1)Cr基态核外电子排布式为________。
(2)K、S、O三种元素的第一电离能由大到小的顺序为________。
(3)乙醇的沸点比甲醚(CH3OCH3)的高,主要原因是________。与H2O空间结构相同的一种阴离子为________(填化学式)。
(4)[Cr(H2O)5Cl]Cl2·H2O是铬(Ⅲ)的一种配合物,1 mol [Cr(H2O)5Cl]2+中含有σ键的数目为________。
(5)某铬铝合金是一种轻质高温材料,其晶胞结构如图所示,该晶体中n(Cr)∶n(Al)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是危害最为严重的大气污染物之一,它主要来自化石燃料的燃烧,研究CO催化还原SO2的适宜条件,在燃煤电厂的烟气脱硫中具有重要价值。
Ⅰ.从热力学角度研究反应
(1) C(s)+O2(g)![]() CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)![]() 2CO(g) ΔH2=+172.5 kJ·mol-1
2CO(g) ΔH2=+172.5 kJ·mol-1
S(s)+O2(g)![]() SO2(g) ΔH3=-296.0 kJ·mol-1
SO2(g) ΔH3=-296.0 kJ·mol-1
写出CO 还原SO2的热化学方程式:_________________。
(2)关于CO还原SO2的反应,下列说法正确的是______。
A.在恒温恒容条件下,若反应体系压强不变,则反应已达到平衡状态
B.平衡状态时,2v正(CO)=v逆(SO2)
C.其他条件不变,增大SO2的浓度,CO的平衡转化率增大
D.在恒温恒压的容器中,向达到平衡状态的体系中充入N2,SO2的平衡转化率不变
Ⅱ.NOx的排放主要来自于汽车尾气,包含NO2和NO,有人提出用活性炭对NOx进行吸附,发生反应如下:
反应a:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0kJ/mol
N2(g)+CO2(g) ΔH=-34.0kJ/mol
反应b:2C(s)+2NO2(g)![]() N2(g)+2CO2(g) ΔH=-64.2kJ/mol
N2(g)+2CO2(g) ΔH=-64.2kJ/mol
(3)对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10min内,NO的平均反应速率v(NO)=___________,当升高反应温度,该反应的平衡常数K___________(选填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是___________(填字母)。
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
(4)①某实验室模拟反应b,在密闭容器中加入足量的C和一定量的NO2气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间NO2的转化率随着压强变化的示意图。请从动力学角度分析,1050kPa前,反应b中NO2转化率随着压强增大而增大的原因_____________;在1100kPa时,NO2的体积分数为___________。

②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp);在T2℃、1.1×106Pa时,该反应的化学平衡常数Kp=___________(计算表达式表示);已知:气体分压(P分)=气体总压(P总)×体积分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(实验1)探究草酸的制备:
实验室用硝酸氧化淀粉(C6H12O6)水解液法(水浴加热)制备草酸,其反应为:C6H12O6+12HNO3 = 3H2C2O4+9NO2↑+3NO↑+9H2O ,装置如图所示:
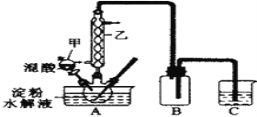
(1)仪器乙的名称为:_________,其接通冷水与水浴加热三颈瓶的先后顺序是:________
(2)烧杯C中盛放的溶液是___________,装置的B作用是______________
(实验2)探究草酸的不稳定性:
已知:草酸晶体(H2C2O4·2H2O)无色,易溶于水,熔点为101℃,受热易脱水、升华,170℃以上分解产生H2O、CO和CO2,其酸性比碳酸强,其钙盐难溶于水。
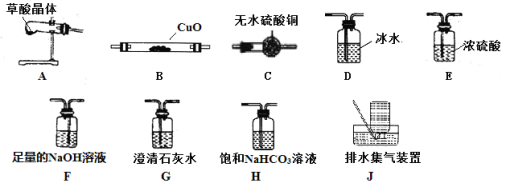
(3)请选取以上的装置证明草酸晶体分解的产物(可重复使用,加热装置和连接装置已略去)。仪器装置连接顺序为:A→_______→______→______→_______→E→B→G→_______。
(4)若实验结束后测得B管质量减轻4.8g,则至少需分解草酸晶体的质量为_________g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com