
 碳、氮、硫、氯是四种重要的非金属元素.
碳、氮、硫、氯是四种重要的非金属元素.| HClO | HSCN | H2CO3 |
| K=3.2×10-8 | K=0.13 | Kl=4.2×10-7 K2=5.6×10-11 |
| c2(NH3) |
| c(N2)c3(H2) |
| 0.42 |
| 0.8×23 |


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
| A、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
| B、将少量SO2通入苯酚钠溶液中:2C6H5O-+SO2+H2O=2C6H5OH+SO32- |
| C、用硫氰化钾溶液可以检验溶液中的Fe3+:Fe3++3SCN-=Fe(SCN)3↓ |
| D、向碘化亚铁溶液中通入过量的氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | (11) |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
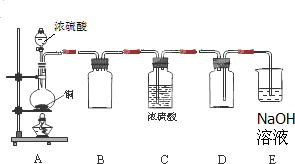 Na2SO3、SO2是中学常见的物质.
Na2SO3、SO2是中学常见的物质.| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 在试管A中加入少量待测液,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色. | |
| 步骤② | 在试管B中加入少量待测液, |
有白色沉淀生成, 证明待测液中含SO42-. |
| 步骤③ | 在试管C中加入少量待测液,滴加2mol/LHCl至溶液呈酸性,加入几滴 |
证明待测液中含SO32-. |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某有机物A,分子中含两个碳原子,现用A来制取有芳香气味的有机物F和加聚高分子化合物E,其变化如图所示:
某有机物A,分子中含两个碳原子,现用A来制取有芳香气味的有机物F和加聚高分子化合物E,其变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠与水反应:O22-+2H2O═2OH-+H2↑ | ||||
| B、用纯碱溶液溶解苯酚:CO32-+2C6H5OH═2C6H5O-+CO2↑+H2O | ||||
C、用石墨作电极电解AlCl3溶液:2Cl-+2H2O
| ||||
| D、将0.2mol/L的NH4Al(SO4)2溶液与0.3mol/L的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+、Na+、SO32-、Cl- |
| B、MnO4-、SO42-、K+、H+ |
| C、Al3+、Mg2+、NO3-、HCO3- |
| D、Fe3+、Na+、SCN-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com