
| A. | Na2CO3-→NaOH | B. | CaCO3-→Ca(OH)2 | C. | NaNO3-→NaCl | D. | CuO-→Cu(OH)2 |
分析 A.碳酸钠与氢氧化钙反应生成碳酸钙和氢氧化钠;
B.CaCO3不溶于水,故不能与可溶性碱反应得到Ca(OH)2;
C.NaNO3不能与其他物质反应生成NaCl;
D.氧化铜不溶于水,与水不反应.
解答 解:A.Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,所以Na2CO3-→NaOH可以一步实现,故A正确;
B.CaCO3不溶于水,故不能与可溶性碱反应得到Ca(OH)2,所以CaCO3-→Ca(OH)2不能一步实现,故B错误;
C.NaNO3不能与其他物质反应生成NaCl,所以NaNO3-→NaCl不能一步实现,故C错误;
D.氧化铜不溶于水,与水不反应,所以CuO-→Cu(OH)2不能一步实现,故D错误;
故选:A.
点评 本题考查了物质之间的转化,熟悉物质的性质及发生的化学反应是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
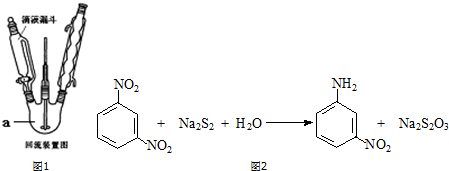
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH2CH2Cl | B. | (CH3)3CCH2OH | C. | CH3CHClCHO | D. | CH2=CHCH2COOCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 已知前四周期六种元素A、B、C、D、E、F的核电荷数依次增大.B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成AC型离子化合物,其中的阴、阳离子相差一个电子层.E4+离子和氩原子的核外电子排布相同,F元素含量决定了人体内血红蛋白携氧能力的大小.请回答:
已知前四周期六种元素A、B、C、D、E、F的核电荷数依次增大.B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成AC型离子化合物,其中的阴、阳离子相差一个电子层.E4+离子和氩原子的核外电子排布相同,F元素含量决定了人体内血红蛋白携氧能力的大小.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
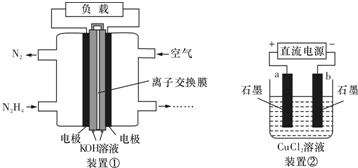
| A. | 该燃料电池负极发生的电极反应为:N2H4+4OH--4e-═N2+4H2O | |
| B. | 用该燃料电池作为装置②的直流电源,产生1molCl2至少需要通入0.5molN2H4 | |
| C. | 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 | |
| D. | 该燃料电池中,电子从右侧电极经过外电路流向左侧电极,溶液中OH-则迁移到左侧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com