
| A. | 金属钠投入到Na2SO4溶液中 | B. | BaCl2和NaHSO4溶液反应 | ||
| C. | 小苏打溶液和澄清石灰水反应 | D. | Na2O2和CuSO4溶液反应 |
分析 A.钠与硫酸钠溶液反应生成氢氧化钠、氢气和硫酸钠;
B.氯化钡与硫酸氢钠反应生成硫酸钡沉淀、盐酸、氯化钠;
C.碳酸氢钠与氢氧化钙反应生成碳酸钙、碳酸钠和水;
D.过氧化钠和硫酸铜溶液反应生成氧气和氢氧化铜.
解答 解:A.金属钠和水反应生成氢氧化钠和氢气,氢氧化钠和Na2SO4溶液不反应,所以无沉淀,故A错误;
B.BaCl2和NaHSO4溶液反应生成硫酸钡沉淀,没有气体生成,故B错误;
C.碳酸氢钠与氢氧化钙反应生成碳酸钙、碳酸钠和水,没有气体生成,故C错误;
D.过氧化钠和水反应生成氢氧化钠和氧气,氢氧化钠和硫酸铜溶液反应生成氢氧化铜蓝色沉淀,故D正确;
故选:D.
点评 本题考查了常见物质的性质及反应,题目难度不大,熟悉钠及其化合物的性质是解题关键,注意对基础知识的积累.


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应每脱去1mol Cl2会生成1molSO42- | |
| B. | 脱氯反应后的溶液显酸性 | |
| C. | 根据该反应可判断还原性:S2O32->Cl- | |
| D. | 反应中硫元素发生了氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
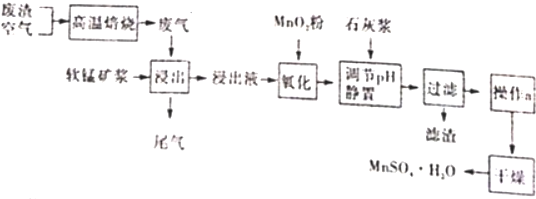
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
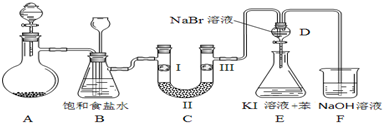
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅与金刚石分子都是正四面体结构 | |
| B. | 硅酸盐都不溶于水? | |
| C. | 硅与酸、碱都不能发生反应 | |
| D. | 原硅酸和硅酸对应的酸酐都是二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com