
用石墨电极电解100mL H2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集到2.24L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为()
A. 1mol•L﹣1 B. 2 mol•L﹣1 C. 3 mol•L﹣1 D. 4 mol•L﹣1
考点: 电解原理.
专题: 电化学专题.
分析: 根据电解池中离子的放电顺序和两极上发生的变化来书写电极反应方程式,并且两个电极上转移的电子数目是相等的,溶液中遵循电荷守恒.
解答: 解:电解0.1LH2SO4和CuSO4的混合溶液,阳极发生的反应为:4OH﹣→2H2O+O2↑+4e﹣,阴极上发生的电极反应为:Cu2++2e﹣→Cu,2H++2e﹣→H2↑,
两极均收集到2.24L(标况)气体,即均生成0.1mol的气体,阳极生成0.1mol氧气说明转移了0.4mol电子,而阴极上生成的0.1molH2只得到了0.2mol电子,
所以剩余0.2mol电子由铜离子获得,且溶液中有0.1mol铜离子,据c=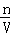 得到铜离子的浓度为:
得到铜离子的浓度为: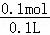 =1mol/L.
=1mol/L.
故选:A.
点评: 本题考查学生电解池的工作原理以及溶液中的电荷守恒思想,难度不大,可以根据所学知识来回答.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
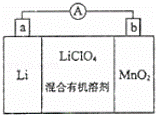
锰锂电池的体积小、性能优良,是常用的一次电池.该电池反应原 理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:
理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:
(1)外电路的电流方向是由b极流向 极(填字母).
(2)电池正极反应式 .
(3)是否可用水代替电池中的混合有机溶剂?否(填“是”或“否”),原因是 .
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为 .K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知3.0g AO32﹣中核外电子数比质子数多6.02×1022个,下列说法中正确的是( )
|
| A. | A原子的摩尔质量32g/mol |
|
| B. | AO32﹣的摩尔质量为60 |
|
| C. | 3.0g AO32﹣ 的物质的量是0.02mol |
|
| D. | A元素的相对原子质量为12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在生产和日常生活中有着重要的应用.下列说法不正确的是()
A. 钢铁的腐蚀过程绝大多数都是电化学腐蚀
B. 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C. 电解CuCl2饱和溶液,生成金属铜和氯气
D. 电解MgCl2饱和溶液,可制得金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
已知热化学方程式:SO2(g)+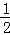 O2(g)⇌SO3(g)△H=﹣98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为()
O2(g)⇌SO3(g)△H=﹣98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为()
A. 196.64kJ B. 196.64kJ/mol C. <196.64kJ D. >196.64kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
按如图所示装置进行实验:A极是铜锌合金,B极为纯铜,电解质中含有足量的铜离子.通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增0.03g,则合金中Cu、Zn原子个数比为()
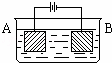
A. 4:1 B. 3:1 C. 2:1 D. 任意比
查看答案和解析>>
科目:高中化学 来源: 题型:
为了测定某铜银合金的成分,将30.0g合金溶于80ml13.5mol/L的浓硝酸中,待合金完全溶解后,收集到标况气体6.72L,并测得溶液的C(H+)=1moL/L,假设反应后溶液的体积仍为80mL,计算:
(1)被还原的硝酸的物质的量.
(2)合金中银的质量分数.
查看答案和解析>>
科目:高中化学 来源: 题型:
已知固体混合物A由NaHCO3、KHCO3、MgCO3、CaCO3四种物质中的两种混合而成,若先将A加热,剩余固体再与足量的盐酸反应,且先后两次产生的气体分别通过足量的澄清石灰水生成的沉淀均为5.0g,则A的物质的量为( )
|
| A. | 0.10mol | B. | 0.20mol | C. | 0.05mol | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
设阿伏加德罗常数为NA,下列说法正确的是( )
|
| A. | 4.4 g乙醛分子中含有的共用电子对数为0.6NA |
|
| B. | 标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA |
|
| C. | 18.8 g苯酚中含有碳碳双键的个数为0.6 NA |
|
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com