
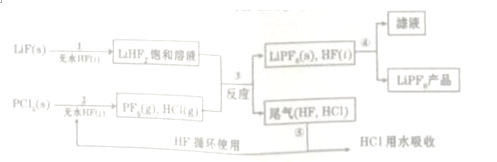
 ,无水HF的作用是反应物和溶剂
,无水HF的作用是反应物和溶剂分析 (1)根据题目中的流程可以看出,固体+液体→新物质+饱和溶液,所以无水HF的作用是反应物和溶剂,氟化锂属于离子化合物;
(2)根据元素组成可知,两种酸分别是H3PO4和HF;
(3)分离尾气中HF、HCl需要依据物质沸点分析,HCl分子间存在范德华力,HF分子间含有氢键,沸点大于HCl,可采用冷凝法分离;
(4)根据Li守恒和质量守恒计算得到LiPF6的物质的量,质量分数=$\frac{LiP{F}_{6}质量}{样品质量}$×100%.
解答 解:(1)根据题目中的流程可以看出,固体+液体→新物质+饱和溶液,所以无水HF的作用是反应物和溶剂,氟化锂属于离子化合物,第①步反应中LiF的电子式是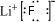 ,
,
故答案为: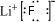 ;反应物和溶剂;
;反应物和溶剂;
(2)根据题目中的信息“PF5极易水解,其产物为两种酸”,则根据元素组成可知,两种酸分别是H3PO4和HF,所以反应的方程式为PF5+4H2O═H3PO4+5HF,PF5与过量NaOH水溶液反应的化学方程式为:PF5+8aOH=Na3PO4+5NaF+4H2O
故答案为:PF5+8aOH=Na3PO4+5NaF+4H2O;
(3)HCl的沸点是-85.0℃,HF的沸点是19.5℃,第⑤步分离尾气中HF、HCl需要将冷凝温度T控制在-85.0°C<T<19.5°C,HF的沸点比HCl的沸点高的原因是HF分子中存在氢键,HCl分子间是范德华力,
故答案为:-85.0°C<T<19.5°C;HF分子中存在氢键,HCl分子间是范德华力;
(4)设LiPF6为mmol,LiF为nmol;根据Li守恒,有m+n=y,根据质量守恒有152m+26n=x,解得m=$\frac{(x-26y)}{126}$mol,该样品中LiPF6的质量分数=$\frac{(x-26y)×152}{126x}$×100%=$\frac{76(x-26y)}{63x}$×100%,
故答案为:=$\frac{76(x-26y)}{63x}$×100%.
点评 本题为无机化学流程题,该题是高考中的常见题型,属于中等难度的试题.试题综合性强,涉及物质推断、分离提纯、方程式书写、化学计算等知识,注意题干所给信息的使用,侧重对学生实验能力的培养和解题方法的指导,有助于培养学生规范、严谨的实验设计和评价能力.


科目:高中化学 来源: 题型:选择题
| A. | 钠熔成小球并在液面上游动 | B. | 溶液底部有银白色物质生成 | ||
| C. | 有气体生成 | D. | 溶液变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
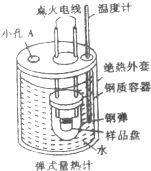 “弹式量热计”(如图所示)可以用来测量硫的燃烧热,实验过程如下:样品盘中加入1.6g硫,钢弹中充入足量的氧气,用电灭花引燃反应,测定小孔反应前后容器中水的温度变化,回答下列间题:
“弹式量热计”(如图所示)可以用来测量硫的燃烧热,实验过程如下:样品盘中加入1.6g硫,钢弹中充入足量的氧气,用电灭花引燃反应,测定小孔反应前后容器中水的温度变化,回答下列间题:| 实验编号 | 实验前温度/℃ | 实验后温度/℃ |
| ① | 24.8 | 28.3 |
| ② | 24.7 | 28.2 |
| ③ | 24.9 | 28.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
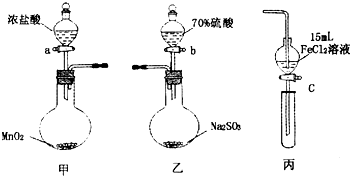 为验证氧化性:Cl2>Fe3+>SO2,某小组用图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验).
为验证氧化性:Cl2>Fe3+>SO2,某小组用图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验).| 步骤3溶液中含有的离子 | 步骤5溶液中含有的离子 | |
| Ⅰ | 既有Fe3+又有Fe2+ | 有SO42- |
| Ⅱ | 有Fe3+无Fe2+ | 有SO42- |
| Ⅲ | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2) | B. | (1)(3) | C. | (2)(3) | D. | (1)(2)(3)(4) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com