
【题目】百服宁口服液为解热镇痛药,主要用于治疗头痛、发烧。其主要化学成分的结构简式为
![]()
下列说法正确的是( )
A.该有机物的分子式为C8H10NO2
B.该有机物属于α-氨基酸
C.含有苯环且属于α-氨基酸的该有机物的同分异构体只有1种
D.该有机物不能与FeCl3溶液发生显色反应
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A. 0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)
B. pH=11的氨水和pH=3的盐酸溶液等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C. 在0.1 mol·L-1 Na2CO3溶液中:2c(Na+)=c(CO![]() )+c(HCO
)+c(HCO![]() )+c(H2CO3)
)+c(H2CO3)
D. 0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃X的比例模型中碳原子的连接方式如图所示(氢原子均省略):![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.X的分子式为C3H6
B.碳氢元素的质量比为8∶1
C.X与足量氯化氢发生加成反应时最多可得到两种产物
D.完全燃烧时消耗氧气的体积是自身体积(相同条件)的4倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】伏打电堆由几组锌和银的圆板堆积而成,所有的圆板之间夹放着几张盐水泡过的布。如图所示为最初的伏打电堆模型,由八组锌和银串联组成的圆板堆积而成。下列说法正确的是
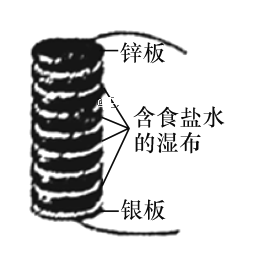
A.该电池发生的反应为析氢腐蚀
B.电池长时间工作后,中间的布上会有白色固体颗粒生成,该固体颗粒为Ag2O
C.当电路中转移0.1 mol电子时,消耗锌板的总质量为26 g
D.该伏打电堆工作时,在银板附近会有Cl2放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列微粒:①CH4 ②CH2=CH2③CH≡ CH④NH3 ⑤NH4+ ⑥BF3 ⑦H2O ⑧H2O2。试回答下列问题。
(1)分子空间构型为正四面体形的是__________(填序号,下同)。
(2)中心原子为sp3杂化的是__________,中心原子为sp2杂化的是__________,中心原子为sp1杂化的是__________。
(3)所有原子共平面(含共直线)的是__________,共直线的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃在工农业生产及人们的生活中具有广泛的用途,如四氯化碳可用作灭火剂,氟利昂可用作冷冻剂,氯仿可用作麻醉剂,卤代烃还是合成高分子化合物的原料。已知下面三个反应(其中A为氯代烃,B为烯烃):
反应①:![]()
反应②:![]()
反应③:![]()
请回答下列问题。
(1)化合物B的分子式为______,![]() 化合物B完全燃烧需要消耗标准状况下_________L的氧气。
化合物B完全燃烧需要消耗标准状况下_________L的氧气。
(2)由丙醇可以制备B,该反应的反应条件为____________,反应类型为___________。
(3)假设A分子中有2种不同化学环境的氢原子,且其个数比为![]() ,那么A在氢氧化钾水溶液中加热反应生成的有机化合物的结构简式为__________________。
,那么A在氢氧化钾水溶液中加热反应生成的有机化合物的结构简式为__________________。
(4)写出B在有机过氧化物(![]() )中与
)中与![]() 反应的化学方程式:______。
反应的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀硫酸的反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2的反应
D.甲烷在O2中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1200mol/LNaOH溶液测定某未知浓度的盐酸溶液,其操作可分解为如下几步:
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是用序号字母填写:__→__→F→__→__→__→D。
(2)操作F中应该选择图中滴定管___填标号。

(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察__。
(4)滴定结果如表所示:
滴定次数 | 待测液体积 | 标准溶液的体积 | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 0.60 | 20.60 |
3 | 25.00 | 0.20 | 20.19 |
计算该盐酸的物质的量浓度为__(精确至0.001)。
(5)下列操作会导致测定结果偏高的是__。
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(6)氧化还原滴定实验与酸碱中和滴定类似用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
Ⅰ、写出用KMnO4滴定H2C2O4的离子方程式__。
Ⅱ、判断滴定终点的方法是__
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com