
【题目】甲醇既是基本有机化工原料,又可作为燃料用于替代矿物燃料。
(1)工业上合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
平衡常数K | 2.041 | 0.270 | 0.012 |
由表中数据判断该反应为 ________反应(填“吸热”或“放热”)。 某温度下,将2 molCO和6 molH2充入2 L的密闭容器中充分反应,达到平衡后,测得c(CO)=0.2 mol/L,则CO的转化率为______,此时的温度为______(从表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2kJ/mol
③H2O(g)=H2O(l) ΔH3kJ/mol
则反应CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH= _____________ kJ/mol(用ΔH1、ΔH2、ΔH3表示)。
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72)时,实验室利用如图装置模拟该法:

①N电极的电极反应式为 ___________________________________。
②请完成电解池中Cr2O72转化为Cr3+的离子反应方程式:
Cr2O72 + ______ Fe2+ + ______ = ______ Cr3+ + ______ Fe3+ + ______
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×105 mol/L时,Cr3+沉淀完全,此时溶液的pH=______。(已知:Ksp=6.4×1031,lg2=0.3)
【答案】放热 80% 250℃ ![]() 或
或![]() (ΔH1-ΔH2)+2ΔH3 O2+4e+4H+=2H2O 6 14H+ 2 6 7H2O 5.6
(ΔH1-ΔH2)+2ΔH3 O2+4e+4H+=2H2O 6 14H+ 2 6 7H2O 5.6
【解析】
(1)由表中数据可知,随温度升高平衡常数减小,说明升高温度平衡逆向移动,则正反应为放热反应;
某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始浓度(mol/L): 1 3 0
变化浓度(mol/L): 0.8 1.6 0.8
平衡浓度(mol/L): 0.2 1.4 0.8
由此计算CO转化率和此温度下平衡常数,进而判断温度;
(2)利用盖斯定律构造目标热化学方程式并求焓变;
(3)①氢离子由质子交换膜由M电极区移向N电极区,则M为负极、N为正极,负极上发生氧化反应,甲醇失去电子,生成二氧化碳与氢离子,正极发生还原反应,氧气获得电子,与通过质子交换膜的氢离子结合为水;
②电解池溶液里Cr2O72-转化为Cr3+,化合价降低共6价,左侧Fe电极为阳极,Fe失去电子生成Fe2+,酸性条件Fe2+将Cr2O72-还原为Cr3+,自身被氧化为Fe3+,化合价升高共1价,化合价升降最小公倍数为6,则Cr2O72-的系数为1,Fe2+的系数为6,再结合电荷守恒、原子守恒配平方程式;
(4)Ksp=c(Cr3+)×c3(OH-)=6.4×1031计算c(OH-),根据KW=c(H+)×c(OH-)计算溶液中c(H+),再根据pH=-lgc(H+)计算。
(1)由表中数据可知,随温度升高平衡常数减小,说明升高温度平衡逆向移动,则正反应为放热反应,故△H<0,某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始浓度(mol/L): 1 3 0
变化浓度(mol/L): 0.8 1.6 0.8
平衡浓度(mol/L): 0.2 1.4 0.8
CO转化率=![]() ×100%=80%,平衡常数K=
×100%=80%,平衡常数K=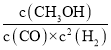 =
=![]() =2.041,故温度为250℃,
=2.041,故温度为250℃,
故答案为:放热;80%;250℃;
(2)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2kJ/mol
③H2O(g)=H2O(l) ΔH3kJ/mol
根据盖斯定律![]() (①②+4×③)可得:CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=
(①②+4×③)可得:CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H= ![]() 或
或![]() (ΔH1-ΔH2)+2ΔH3;
(ΔH1-ΔH2)+2ΔH3;
(3)①氢离子由质子交换膜由M电极区移向N电极区,则M为负极、N为正极,负极上发生氧化反应,甲醇失去电子,生成二氧化碳与氢离子,负极电极反应式为:CH3OH6e+H2O=6H++CO2↑,正极发生还原反应,氧气获得电子,与通过质子交换膜的氢离子结合为水,正极电极反应式为:O2+4e+4H+=2H2O,
故答案为:O2+4e+4H+=2H2O;
②电解池溶液里Cr2O72-转化为Cr3+,化合价降低共6价,左侧Fe电极为阳极,Fe失去电子生成Fe2+,酸性条件Fe2+将Cr2O72-还原为Cr3+,自身被氧化为Fe3+,化合价升高共1价,化合价升降最小公倍数为6,则Cr2O72-的系数为1,Fe2+的系数为6,反应离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案为:6;14H+;2;6;7H2O;
(4)Ksp=c(Cr3+)×c3(OH)=6.4×10-31,c(Cr3+)=1×10-5mol·L1时,溶液中c(OH)=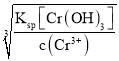 =
=![]() =4×10-9mol·L1,则c(H+)=
=4×10-9mol·L1,则c(H+)=![]() =
=![]() mol/L=2.5×10-6mol·L1,则pH=lg(2.5×10-6) =5.6。
mol/L=2.5×10-6mol·L1,则pH=lg(2.5×10-6) =5.6。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某同学在实验室中进行如图所示实验。
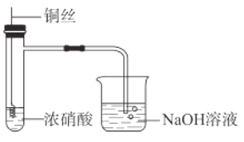
(1)铜丝与浓硝酸发生反应的离子方程式是________。
(2)烧杯中NaOH溶液的作用是________。
(3)铜丝下端弯成螺旋状的原因是________。
(4)根据反应产生的现象,从不同角度推断该反应所属反应类型:
①根据________现象,可推断该反应为氧化还原反应。
②根据反应后试管壁发热的现象,可推断该反应属于________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科技进步和人类环保意识的增强,如何利用CO2已经成为世界各国特别关注的问题。
已知:CO2与CH4经催化重整制得合成气:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) △H
2CO(g)+2H2(g) △H
(1)降低温度,该反应速率会_______________(填“增大”或“减小”);一定压强下,由最稳定单质生1 mol化合物的焓变为该物质的摩尔生成焓。已知CO2(g)、CH4(g)、CO(g)的摩尔生成焓分别为-395 kJ/mol、-74.9 kJ/mol、-110.4 kJ/mol。则上述重整反应的ΔH=____________kJ/mol。
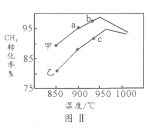
(2)T1℃时,在两个相同刚性密闭容器中充入CH4和CO2分压均为20 kPa,加入催化剂Ni/α-Al2O3并分别在T1℃和T2℃进行反应,测得CH4转化率随时间变化如图Ⅰ所示。
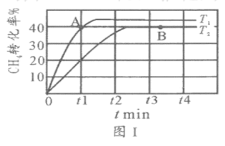
①A点处v正_______B点处(填“<”、“>”或“=”)
②研究表明CO的生成速率v生成(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,A点处v生成(CO)=__________mol·g-1·s-1。
(3)上述反应达到平衡后,若改变某一条件,下列变化能说明平衡一定正向移动的是________________(填代号)。
A.正反应速率增大 B.生成物的百分含量增大 C.平衡常数K增大
(4)其他条件相同,在甲、乙两种不同催化剂作用下,相同时间内测得CH4转化率与温度变化关系如图Ⅱ,C点___________________(填“可能”、“一定”或“一定未”)达到平衡状态,理由是_____________;CH4的转化率b点高于a点的可能原因是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂-空气电池具有能量密度高的优点,有希望成为新能源汽车的电源,其结构如图所示,下列说法正确的是( )

A.电子从金属锂流出通过外电路流向石墨烯,固体电解质允许通过水
B.放电时,正极反应式:O2+4e-+4H+=2H2O
C.应用该电池电镀铜,阴极质量增加64g,理论上将消耗11.2LO2
D.若把水性电解液换成固体氧化物电解质,则易引起正极材料碳孔堵塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ/mol
B.500℃、30MPa下,将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ/mol
2NH3(g) △H=-38.6kJ/mol
C.已知乙醇和乙烯的燃烧热分别为1366.8kJ·mol-1和1411.0kJ·mol-1,则乙烯水化制乙醇的热化学方程式为:CH2=CH2(g)+H2O(l)=C2H5OH(l) ΔH=-44.2kJ·mol-1
D.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3kJ/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质检验的实验操作、现象及结论均正确的是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO |
B | 向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
C | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定为SO2 |
D | 向某溶液中加入氢氧化钠溶液并加热,产生有刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红 | 该溶液中一定含有NH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:

(1)反应开始至2min,以气体Z表示的平均反应速率为_________.
(2)该反应的化学方程式为_________.
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:此时体系的压强是开始时的_________倍;达平衡时,容器内混合气体的平均相对分子质量比起始投料时_________(填"增大""减小"或"相等").
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl 是难溶于水的白色固体,是一种重要的催化剂。工业上,由孔雀石(主要成分Cu(OH)2·CuCO3, 含FeS、FeO 和SiO2杂质)制备CuCl 的某流程如下

下列说法不正确的是
A.H2O2将溶液1 中Fe2+氧化为Fe3+,再通过控制pH 转化为Fe(OH)3除去
B.CO32-作用是控制溶液pH,促使CuCl 沉淀的生成
C.SO32-将溶液3 中的Cu2+还原,反应得到CuCl
D.若改变试剂加入顺序,将溶液3 缓慢加入到含大量SO32-/CO32-的溶液中,同样可制取CuCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从樟科植物枝叶提取的精油中含有下列甲、乙两种成分:
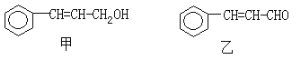
(1)乙中所含官能团的名称为____________________。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
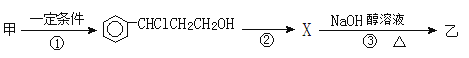
设计步骤①的目的是_________________________,反应②的化学方程式为_________________(注明反应条件)。
(3)欲检验乙中的含氧官能团,选用下列的一种试剂是_______________(填序号)。
A.溴水 B.酸性高锰酸钾溶液 C.溴的CCl4溶液 D.银氨溶液
(4)乙经氢化和氧化得到丙(![]() )。写出同时符合①能发生银镜反应;②能与FeCl3溶液发生显色反应;③核磁共振氢谱图上产生4个吸收峰等要求的丙的同分异构体结构简式_______________、________________。
)。写出同时符合①能发生银镜反应;②能与FeCl3溶液发生显色反应;③核磁共振氢谱图上产生4个吸收峰等要求的丙的同分异构体结构简式_______________、________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com