
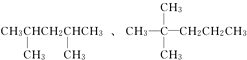
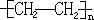
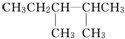 、
、 ,名称分别是2,3二甲基戊烷和3,3二甲基戊烷;
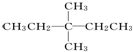
,名称分别是2,3二甲基戊烷和3,3二甲基戊烷;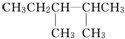 2,3二甲基戊烷;
2,3二甲基戊烷; 3,3二甲基戊烷;
3,3二甲基戊烷;| 催化剂 |
 ,
,| 催化剂 |
 ,
,


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、单质硅是将太阳能转化为电能的常用材料 |
| B、硅酸钠的俗名为玻璃,可用于制备硅胶和木材防火剂 |
| C、用浓H2SO4刻蚀工艺玻璃上的纹饰 |
| D、SO2具有氧化性,可用来漂白纸浆 |
查看答案和解析>>
科目:高中化学 来源: 题型:
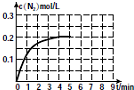 研究化学反应,不仅要关注反应的速率、方向性,还要关注反应进行的限度以及反应过程中的能量变化.
研究化学反应,不仅要关注反应的速率、方向性,还要关注反应进行的限度以及反应过程中的能量变化.| 0 | 1min | 2min | 4min | 5min | |
| 130℃ | 0.50mol | 0.35mol | 0.25mol | 0.10mol | 0.10mol |
| 180℃ | 0.50mol | 0.30mol | 0.18mol | 0.15mol |
| c2(N2)?c2(H2O) |
| c2(NH3)?c(NO)?c(NO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ⑨ | ① | ② | ⑧ | ||||
| 3 | ③ | ⑦ | ④ | ⑤ | ⑥ | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO和SiO2都不能和水反应,所以它们都不是酸性氧化物 |
| B、易溶于水的化合物溶于水的过程不一定有化学键断裂的过程 |
| C、Na2O2是离子化合物,含有极性键和离子键 |
| D、氢氧化铝是两性氢氧化物,既可溶解于浓氨水又可溶解于盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由极性键构成的分子不一定是极性分子 |
| B、NaCl晶体中与每个Na+距离相等且最近的Cl-共有6个 |
| C、萃取原理来源于相似相容原理 |
| D、两种元素的原子结构的共价化合物分子中的化学键都是极性键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com