
【题目】利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组模拟上述过程,所设计的装置如图所示:
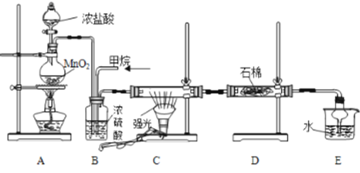
(1)A中制取Cl2时若将MnO2换成另一种固体即可不用加热并能快速制取氯气,写出该快速制氯气过程的离子方程式为______。
(2)B装置有三种功能:①控制气流速度;②___________;③___________。
(3)D装置中的石棉上吸附着潮湿的KI,其作用是___________。
(4)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法是___________。
(5)该装置还存在的明显缺陷是____________。
(6)将1 mol CH4与Cl2发生取代反应,测得4种有机取代产物的物质的量相等,则消耗的氯气的物质的量是________。
【答案】2MnO4-+ 10Cl- + 16H+ = 2Mn2+ + 5Cl2↑ + 8H2O 干燥混合气体(或吸水) 使气体混合均匀 除去过量的Cl2 分液 未吸收CH3Cl等尾气 2.5mol
【解析】
(1) 高锰酸钾具有更强的氧化性,可以将浓盐酸中Cl-氧化生成氯气;(2)生成的氯气中还含有水分,浓硫酸具有吸水性,所以B装置除了控制气流速度、均匀混合气体外,还有干燥作用;(3) 氯气具有强的氧化性,能够与碘化钾反应;(4) 分离两种互不相溶的液体用分液法;(5) 装置中通常分为发生装置、除杂装置、收集装置和尾气处理装置;(6)根据甲烷的物质的量计算出四种取代产物的物质的量,再根据甲烷与氯气的取代反应特点计算出消耗氯气的物质的量。
(1) 高锰酸钾能将HCl(浓)氧化生成Cl2,本身被还原生成Mn2+,离子方程式为:2MnO4-+ 10Cl- + 16H+ = 2Mn2+ + 5Cl2↑ + 8H2O,故答案为:2MnO4-+ 10Cl- + 16H+ = 2Mn2+ + 5Cl2↑ + 8H2O;
(2) 生成的氯气中含有水,B装置除具有控制气流速度、均匀混合气体之外,因浓硫酸具有吸水性,还具有干燥作用,故答案为:干燥混合气体(或吸水);均匀混合气体;
(3) 氯气具有强的氧化性,能够与碘化钾反应而被碘化钾吸收,所以D装置中的石棉上吸附着潮湿的KI粉末,其作用是除去Cl2;故答案为:除去过量的Cl2;
(4) 甲烷与氯气发生取代反应生成取代物与盐酸互不相溶,可以用分液法分离二者,故答案为:分液;
(5) 甲烷与氯气发生取代反应生成取代物,则该装置存在的明显缺陷是未吸收CH3Cl等尾气,故答案为:未吸收CH3Cl等尾气;
(6) 1mol甲烷与氯气完全反应生成四种有机产物的物质的量相同,即分别生成了0.25molCH3Cl(气体)、CH2Cl2、CHCl3、CCl4,根据取代反应特点,每取代1molH原子,需要消耗1mol氯气,则总共消耗氯气的物质的量为:0.25mol+0.25mol×2+0.25mol×3+0.25mol×4=2.5mol,故答案为:2.5mol。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】化合物H可用以下路线合成:
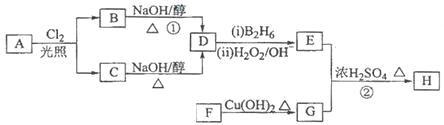
已知:![]()
请回答下列问题:
(1)标准状况下11.2L烃A在氧气中充分燃烧可以生成88gCO2和45gH2O,且A分子结构中有3个甲基,则A的结构简式为________________________;
(2)B和C均为一氯代烃,D的名称(系统命名)为_________________;
(3)在催化剂存在下1molF与2molH2反应,生成3—苯基—1—丙醇。F的结构简式是___________;
(4)反应①的反应类型是_______________________;
(5)反应②的化学方程式为______________________________________;
(6)写出所有与G具有相同官能团的芳香类同分异构体的结构简式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(18分)从薄荷油中得到一种烃A(C10H16),叫ɑ—非兰烃,与A相关反应如下:
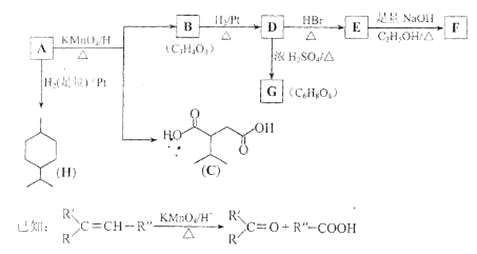
(1)H的分子式为 。
(2)B所含官能团的名称为 。
(3)含两个—COOCH3基团的C的同分异构体共有 种(不考虑手性异构),其中核磁共振氢谱呈现2个吸收峰的异构体结构简式为 。
(4)B→D,D→E的反应类型分别为 、 。
(5)G为含六元环的化合物,写出其结构简式: 。
(6)F在一定条件下发生聚合反应可得到一种高级吸水性树脂,该树脂名称为 。
(7)写出E→F的化学方程式: 。
(8)A的结构简式为 ,A与等物质的量的Br2进行加成反应的产物共有 种(不考虑立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列两种转化途径,某些反应条件和产物已省略。下列有关说法不正确的是
途径① S![]() H2SO4
H2SO4
途径② S![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
A. 途径①反应中体现了浓硝酸的强氧化性和酸性
B. 途径②的第二步反应在实际生产中可以通过增大O2浓度来降低成本
C. 由途径①和②分别制取1 mol H2SO4,理论上各消耗1 mol S,各转移6 mol e-
D. 途径②与途径①相比更能体现“绿色化学”的理念是因为途径②比途径①污染相对小且原子利用率高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4是天然气主要成分,天然气是一种高效、低耗、污染小的清洁能源,也是重要的化工原料。
(1)CH4除了可以直接燃烧供能外,还可用作燃料电池的燃料,写出如图所示甲烷燃料电池负极的电极反应式_________。
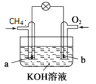
(2)以CH4为原料制取H2是工业上常用的制氢方法,化学方程式为:CH4(g)+H2O(g) CO(g)+3H2(g),该反应为吸热反应。一定温度下,将CH4和H2O(g)各0.11 mol充入2L恒容密闭容器中,50s后达平衡状态:
①若平衡时压强与初始压强比为21:11,平衡时CH4的浓度为____,50s内用H2表示该反应的平均速率 v(H2)=____。
②以下可作为该反应达平衡状态的标志的是________。
A.气体总压强保持不变 B.气体的密度保持不变 C.单位时间消耗1molCH4的同时生成3molH2 D.气体的平均摩尔质量保持不变 E.CO和H2的分子数之比为1:3
(3)与甲烷结构相似的有机物还有很多,它们的碳原子之间都以碳碳单键结合成链状,剩余价键均与氢原子结合,这样的烃称为烷烃。
①分子式为C7H16,含有三个甲基的的烷烃可能结构有_____种
②烷烃CH3CH(C2H5)C(CH3)3的一氯代物有_____种,系统命名为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种物质存在如图所示的转化关系(图中“→”表示一步转化)。下列各组物质中,不能满足此转化关系的是( )
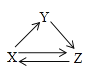
物质 选项 | X | Y | Z |
A | Al | Al2O3 | NaAlO2 |
B | Fe | FeCl3 | FeCl2 |
C | C | CO | CO2 |
D | Cl2 | HCl | NaCl |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向某固定容积的密闭容器中加入1molN2和3molH2,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)。此反应达到平衡的标志是
2NH3(g)。此反应达到平衡的标志是
A. 容器内气体密度不再发生变化
B. 容器内气体的平均相对分子质量不再发生变化
C. N2、H2和NH3的物质的量浓度之比为1:3:2
D. 单位时间消耗0.1 mol N2的同时生成0.2 mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中沉淀的物质的量(Y)与加入的试剂的量(X)之间的关系正确的是( )
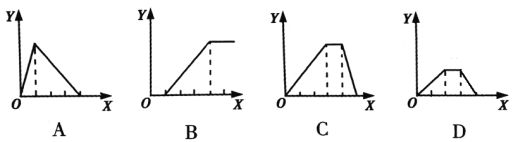
A.如图A:向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡
B.如图B:向NaAlO2溶液中滴加盐酸且边滴边振荡
C.如图C:向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液直至过量
D.如图D:向等物质的量的NaOH、Ba(OH)2的混合溶液中逐渐通入二氧化碳至过量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com