
【题目】已知二元弱碱B(OH)2在水中存在如下电离平衡:B(OH)2 ![]() B(OH)++OH-,Kb1=10-3.75;B(OH)+
B(OH)++OH-,Kb1=10-3.75;B(OH)+![]() B2++OH-,Kb2=10-7.62。常温下,用0.1 mol/L盐酸滴定25 mL 0.1 mol/L的B(OH)2溶液,得到如图所示的滴定曲线。下列说法不正确的是
B2++OH-,Kb2=10-7.62。常温下,用0.1 mol/L盐酸滴定25 mL 0.1 mol/L的B(OH)2溶液,得到如图所示的滴定曲线。下列说法不正确的是

A. a点所得的溶液中:c[B(OH)2]= c[B(OH)+]
B. b点所得的溶液中:c[B(OH)2] +c(OH-)=c(B2+)+c(H+)
C. c点所得的溶液中:c(Cl-)<3c[B(OH)+]
D. d点所得的溶液中:c(B2+)>c[B(OH)+]>c[B(OH)2]
【答案】C
【解析】
A.a点时,pH=10.25,则c(H+)=10-10.25,c(OH-)=![]() ,由于Kb1=
,由于Kb1=![]() 10-3.75,所以c[B(OH)2]= c[B(OH)+],A正确;
10-3.75,所以c[B(OH)2]= c[B(OH)+],A正确;
B. b点所得的溶液中,由于二者浓度相等、体积相等,所以n(HCl)=n[B(OH)2],二者反应的物质的量的比是1:1,根据物料守恒可得:c(Cl-)= c[B(OH)2]+ c[B(OH)+]+ c(B2+);根据电荷守恒可得: c[B(OH)+]+2c(B2+)+c(H+)= c(Cl-)+ c(OH-)=c(OH-)+ c[B(OH)2]+ c[B(OH)+]+ c(B2+),整理可得:c[B(OH)2] +c(OH-)=c(B2+)+c(H+),B正确;
C.c点所得的溶液中,pH=6.38,溶液显弱酸性,c(H+)>c(OH-),c(H+)=10-6.38,则c(OH-)=![]() ,由于Kb2=
,由于Kb2=![]() =10-7.62,则c(B2+)=c[B(OH)+];根据电荷守恒可得 c[B(OH)+]+2c(B2+)+c(H+)= c(Cl-)+ c(OH-),将c(H+)>c(OH-)、c(B2+)=c[B(OH)+]代入电荷守恒式,可得c(Cl-)>3c[B(OH)+],因此C错误;
=10-7.62,则c(B2+)=c[B(OH)+];根据电荷守恒可得 c[B(OH)+]+2c(B2+)+c(H+)= c(Cl-)+ c(OH-),将c(H+)>c(OH-)、c(B2+)=c[B(OH)+]代入电荷守恒式,可得c(Cl-)>3c[B(OH)+],因此C错误;
D.在d点,n(HCl)=2n[B(OH)2],恰好反应产生正盐BCl2,由于B(OH)2是二元弱碱,所以B2+会发生一级水解产生B(OH)+, B(OH)+发生二级水解反应产生B(OH)2,盐的水解程度是比较小的,一级水解远远大于二级水解,故溶液中BCl2主要以其电离产生的B2+的形式存在,因此,d点所得的溶液中离子浓度大小关系为:c(B2+)>c[B(OH)+]>c[B(OH)2],D正确。
综上所述,不正确的选项是C,故本题选C。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32- )、c(HCO3)都减少,其方法是
A. .加入氢氧化钠固体 B. 加氯化钠固体 C. 通入二氧化碳气体 D. 加入氢氧化钡固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物a( )、b(
)、b(![]() )、c(
)、c(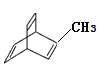 )
)
A. a、b、c均能与溴水发生加成反应
B. a、b、c的分子式均为C8H8
C. a的所有原子一定处于同一一平面
D. b的二氯代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在除杂质的实验操作中,为了将溶液中的杂质完全去除,通常需加入过量的除杂质试剂。某校化学课外活动小组为了除去粗盐中含有少量Na2SO4、MgCl2,设计了下列实验步骤:

试简要说明:
(1)加入过量BaCl2的溶液的原因___________________。
(2)加入过量Na2CO3的溶液的原因_________________________。
(3)滴加稀盐酸直至pH=7的目的是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用H2O2和H2SO4的混合溶液可溶出印刷电路板中的铜,其热化学方程式为Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l) ΔH已知①Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1=+64 kJ·mol-1②2H2O2(l)===2H2O(l)+O2(g) ΔH2=-196 kJ·mol-1③H2(g)+1/2O2(g)===H2O(l) ΔH3=-286kJ·mol-1。下列说法不正确的是
A. 反应①可通过铜作电极电解稀H2SO4的方法实现
B. 反应②在任何条件下都能自发进行
C. 若H2(g)+1/2O2(g)===H2O(g) ΔH4,则ΔH4<ΔH3
D. ΔH=-320 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌浮渣主要含Zn、ZnO、SiO2、Fe2+、Cd2+、Mn2+,工业上可通过控制条件逐一除去杂质以制备超细活性氧化锌,其工艺流程如下:

(1)滤渣1的成分为___________。
(2)在S2O82-的结构式中只含有一根“O一O”非极性键,则S的化合价为___________;工业上常用惰性电极电解(NH4)2SO4生产(NH4)2S2O8(过二硫酸铵),阳极电极反应式为__________________。净化1是为了将Mn2+转化为MnO2而除去,写出该反应的离子方程式:______________________。
(3)净化3的目的_________________________________。
(4)碳化回收溶液的主要成分为___________,该物质循环使用的目的___________________。
(5)碳化在50℃进行,“前驱体”的化学式为ZnCO3·2Zn(OH)2·H2O,写出碳化过程生成“前驱体”的化学方程式:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
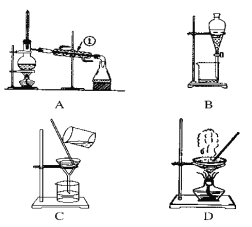
(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置________。
(2)从碘水中分离出I2,选择装置________,该分离方法的名称为________。
(3)装置A中①的名称是________,进水的方向是从________口进水。装置B在分液时为使液体顺利滴下,除打开活塞外,还应进行的具体操作是____。
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:
![]()
![]()
![]()
![]()
![]() ―→
―→![]()
粗盐中含Ca2+、Mg2+、Fe3+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:
①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③加入过量的NaOH溶液 ④调节溶液的pH等于7 ⑤溶解 ⑥过滤 ⑦蒸发
正确的操作顺序是________(填选项字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦
c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com