
| A. | 蔗糖与浓硫酸反应中有海绵状的炭生成,是因为浓硫酸具有吸水性能使蔗糖炭化 | |
| B. | 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体,体现浓硫酸的强氧化性 | |
| C. | 浓硫酸是一种干燥剂,能够干燥硫化氢、氢气等气体 | |
| D. | 浓硫酸在常温下可用铁桶盛装,是因为常温下浓硫酸能够使铁、铝等金属钝化 |
分析 A.浓硫酸具有脱水性,能够是某些有机物脱水炭化;
B.浓硫酸与铜反应条件为加热;
C.浓硫酸具有强的氧化性、酸性,不能干燥还原性气体、碱性气体;
D.常温下浓硫酸遇到铁发生钝化.
解答 解:A.蔗糖与浓硫酸反应中有海绵状的炭生成,是因为浓硫酸具有脱水性能使蔗糖炭化,故A错误;
B.浓硫酸在常温下与铜不反应,故B错误;
C.硫化氢具有还原性,能够被浓硫酸氧化,不能用浓硫酸干燥,故C错误;
D.常温下浓硫酸遇到铁发生钝化,形成致密氧化膜阻止反应进行,所以浓硫酸在常温下可用铁桶盛装,故D正确;
故选:D.
点评 本题考查了浓硫酸的性质,熟悉浓硫酸的强氧化性、吸水性、脱水性、酸性是解题关键,注意脱水性与吸水性的区别,题目难度不大.


科目:高中化学 来源: 题型:解答题
 双氰胺结构简式如图1.
双氰胺结构简式如图1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子数之比是1:1 | B. | 原子个数比是3:2 | C. | 质子数比是 3:2 | D. | 密度之比是1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 混合物 | 碳酸钙和水 | 食盐和水 | 汽油和植物油 | 碘和CCl4 |
| 分离方法 | 过滤 | 蒸发 | 分液 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
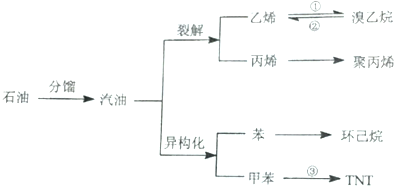
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
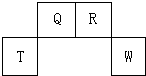 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: ;W在周期表中的位置是第三周期VIA族;
;W在周期表中的位置是第三周期VIA族;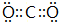 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com