
(13分)
Cl2是一种重要的化工原料。
(1)电解饱和NaCl溶液获得Cl2的化学方程式是_______。
(2)为便于储存,要将氯气液化[ Cl2(g)  Cl2(l) ],应采取的措施是_______(写出一条即可)。
Cl2(l) ],应采取的措施是_______(写出一条即可)。
(3)液氯储存区贴有的说明卡如下(部分):
| 危险性 | 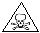 |
| 储运要求 | 远离金属粉末、氨、烃类、醇更物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
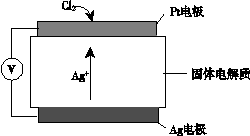

(13分)
(1)2NaCl + 2H2O 电解 2NaOH + H2↑+ Cl2↑
(2)降温 (或加压)
(3)① HSO3- + Cl2 +H2O ="=" SO42- + 2Cl- + 3H+
② 铁与氯气反应生成的氯化铁,对氯与苯的反应有催化作用
③ Cl2 + 2e- + 2Ag+ ="=" 2AgCl
(4)① Cl2 + 2OH- ="=" Cl- + ClO- + H2O
② 分别测定通液氯样品前后a、c 的质量
解析试题分析:(1)电解饱和NaCl溶液生成氢氧化钠、氢气、氯气,化学方程式为2NaCl + 2H2O 电解 2NaOH + H2↑+ Cl2↑
(2)将氯气液化,使Cl2(g)  Cl2(l)平衡正向移动,可以加压;气体液化是放热过程,所以还可以降低温度;
Cl2(l)平衡正向移动,可以加压;气体液化是放热过程,所以还可以降低温度;
(3)①NaHSO3溶液与氯气发生氧化还原反应生成硫酸钠和氯化氢,离子方程式为HSO3- + Cl2 +H2O ="=" SO42- + 2Cl- + 3H+;
②钢瓶中含有铁,与氯气反应生成氯化铁,对苯和氯气的反应起催化作用;
③Cl2在Pt电极放电生成氯离子,与银离子结合成氯化银沉淀,从而检测氯气,电极反应式为Cl2 + 2e- + 2Ag+ ="=" 2AgCl
(4)①c装置用于吸收氯气,测定氯气的质量,离子方程式为Cl2 + 2OH- ="=" Cl- + ClO- + H2O
②该装置是检测液氯的含水量,所以需要知道氯气和水的质量,a装置吸收水,c装置吸收氯气,因此需要分别测定通液氯样品前后a、c 的质量。
考点:考查电解饱和食盐水的化学方程式,平衡的移动,离子方程式的书写,装置作用的判断,电化学原理的应用


科目:高中化学 来源: 题型:填空题
1200℃时可用反应 2BBr3(g)+ 3H2(g) 2B(s) + 6HBr(g) 来制取晶体硼。完成下列填空:
2B(s) + 6HBr(g) 来制取晶体硼。完成下列填空:
(1)下列说法能说明该反应达到平衡的是______(选填序号,下同)。
a. v正(BBr3)= 3v逆(HBr) b. 2c(H2) = c(HBr)
c.密闭容器内压强不再变化 d. 容器内气体平均摩尔质量不再变化
(2)若密闭容器体积不变,升高温度,晶体硼的质量增加,下列说法正确的是_________。
a. 在平衡移动时正反应速率先增大后减小
b. 在平衡移动时逆反应速率始终增大
c. 正反应为放热反应
d. 达到新平衡后反应物不再转化为生成物
(3)若上述反应在10L的密闭容器内反应,5min后,气体总质量减少1.1 g,则该时间段内氢气的平均反应速率为__________________。
(4)往容器中充入0.2 mol BBr3和一定量H2,充分反应达到平衡后,混合气体中HBr百分含量与起始通入H2的物质的量有如图关系。在a、b、c三点中,H2 的转化率最高的是______(选填字母)。b点达到平衡后,再充入H2使平衡到达c点,此过程中平衡移动的方向为__________(填“正向”、“逆向”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(18分)为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。
2NO(g),是导致汽车尾气中含有NO的原因之一。
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+O2(g) 2NO(g)的△H__________0(填“>”或“<”)。
2NO(g)的△H__________0(填“>”或“<”)。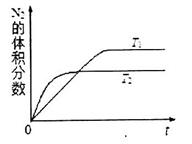
②在T3温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v (N2)=___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
(2)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。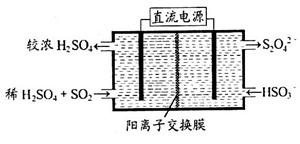
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32—生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol·L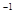 的醋酸与b mol
的醋酸与b mol L
L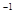 Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号)__________
| A.生成CH3OH的速率与消耗CO的速率相等 | B.混合气体的密度不变 |
| C.混合气体的相对平均分子质量不变 | D.CH3OH、CO、H2的浓度都不再发生变化 |
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
[15分]甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
| 反应过程 | 化学方程式 | 焓变△H (kJ/mol) | 活化能Ea (kJ/mol) |
| 甲烷氧化 | CH4(g)+2O2(g) CO2(g)+2H2O(g) CO2(g)+2H2O(g) | -802.6 | 125.6 |
CH4(g)+O2(g) CO2(g)+2H2(g) CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸汽重整 | CH4(g)+H2O(g) CO(g)+3H2(g) CO(g)+3H2(g) | 206.2 | 240.1 |
CH4(g)+2H2O(g) CO2(g)+4H2(g) CO2(g)+4H2(g) | 165.0 | 243.9 |
 CO2(g)+H2(g)的△H= kJ/mol。
CO2(g)+H2(g)的△H= kJ/mol。 CO(g)+3H2(g)的KP= ;
CO(g)+3H2(g)的KP= ;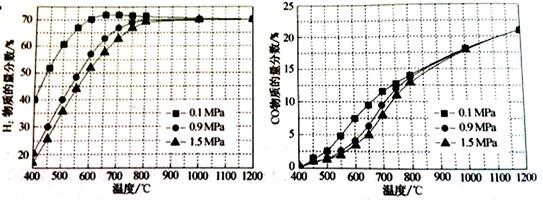
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)近年来雾霾天气多次肆虐我国部分地区。其中燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)。在密闭容器
2CO2(g)+ N2(g)。在密闭容器
中发生该反应时,c(CO2)随温度(T)和时间(t)的变化曲线如图1所示。据此判断:
①该反应的△H 0(填“<”或“>”)。
②在T2温度下,0~2s内的平均反应速率v (N2)为 。
③若该反应在绝热、恒容的密闭体系中进行,下列图2中正确且能说明反应在进行到t1时刻达到平衡状态的是 (填字母编号)。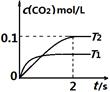
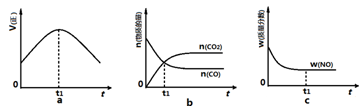
图1 图2
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气中含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol ①
2NO2(g)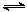 N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②
H2O(g)=H2O(l) △H=-44.0 kJ/mol ③
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式 。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL 1 mol/L食盐
水的装置,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。
①该燃料电池的负极反应式为 。
②电解后溶液的pH约为 (忽略氯气与氢氧化钠溶液反应)。
③阳极产生气体的体积在标准状况下约为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
I.800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应CO(g)+H2O(g) H2(g)+CO2(g),反应过???中测定的部分数据见下表:
H2(g)+CO2(g),反应过???中测定的部分数据见下表:
| 反应时间/min | 0 | 2 | 4 | 6 |
| n(CO)/mol | 1.20 | 0.90 | | 0.80 |
| n(H2O)/ mol | 0.60 | | 0.20 | |


 2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。
2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。查看答案和解析>>
科目:高中化学 来源: 题型:计算题
在密闭容器中将NO2加热到某温度时,进行如下的反应:2NO2 2NO+O2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为:c(NO2)=0.06 mol/L,c(NO)=0.24 mol/L。试求:
2NO+O2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为:c(NO2)=0.06 mol/L,c(NO)=0.24 mol/L。试求:
(1)NO2的转化率为多少?
(2)反应前后的压强比为多少?
(3)计算该温度下反应的平衡常数.
(4)在这5分钟内,用O2来表示的平均反应速率是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(1)N2(g)+3H2(g) 2NH3(g) △H=-94.4kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。
2NH3(g) △H=-94.4kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。
①在1L容器中发生反应,前20min内,v(NH3)= ,放出的热量为 ;
②25min时采取的措施是 ;
③时段III条件下,反应的平衡常数表达式为 (用具体数据表示)。
(2)电厂烟气脱氮的主反应①:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g)
5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g) 5N2O(g)+3H2O(g) △H>0。平衡混合气中N2与N2O含量与温度的关系如右图。请回答:在400K~600K时,平衡混合气中N2含量随温度的变化规律是 ,导致这种规律的原因是 (任答合理的一条原因)。
5N2O(g)+3H2O(g) △H>0。平衡混合气中N2与N2O含量与温度的关系如右图。请回答:在400K~600K时,平衡混合气中N2含量随温度的变化规律是 ,导致这种规律的原因是 (任答合理的一条原因)。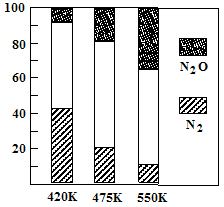
(3)直接供氨式燃料电池是以NaOH溶液为电解质的。电池反应为:4NH3+3O2=2N2+6H2O,则负极电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com