
| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| A、已知醋酸铵溶液呈中性,在①、②两中分别加入适量的氯化铵晶体或醋酸铵晶体后,两溶液的pH均减小 |
| B、四种溶液分别加水稀释10倍,四种溶液的pH①>②>④>③ |
| C、①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、VaL④溶液与VbL②溶液混合后,若混合后溶液pH=4,则Va:Vb=11:9 |
| 10-3Va-10-3Vb |
| Va+Vb |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+、K+、Ag+、NO3-、 |
| B、Mg2+、Na+、CO32-、SO42- |
| C、NH4+、Al3+、Cl-、NO3- |
| D、Na+、K+、CO32-、C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①③ | C、①④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使甲基橙变红的溶液:Fe2+、K+、SO42-、NO3- |
| B、加入铝粉产生氢气的溶液:Na+、K+、SO42-、Cl- |
| C、0.1 mol?L-1NaAlO2溶液:Al3+、Na+、Cl-、NO3- |
| D、水电离出的c(H+)=10-12 mol?L-1的溶液:Na+、K+、NH4+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定温度下,三种碳酸盐MCO3(M2+:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示.已知:p(M2+)=-lgc(M2+),p(CO32-)=-lgc(CO32-).下列说法正确的是( )
一定温度下,三种碳酸盐MCO3(M2+:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示.已知:p(M2+)=-lgc(M2+),p(CO32-)=-lgc(CO32-).下列说法正确的是( )| A、MgCO3、CaCO3、MnCO3的Ksp依次增大 |
| B、在100mL MgCO3、CaCO3、MnCO3饱和的混和溶液中加入足量浓K2CO3溶液,产生沉淀MnCO3质量最多 |
| C、b点可表示CaCO3的饱和溶液,且Ca2+浓度与CO32-浓度相等 |
| D、c点若表示MgCO3则为不饱和溶液,若表示CaCO3则有沉淀析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、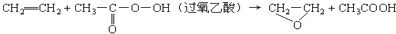 |
B、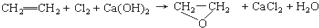 |
C、 |
D、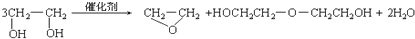 |
查看答案和解析>>
科目:高中化学 来源: 题型:
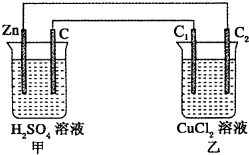 仔细分析如图装置,完成下面的填空.
仔细分析如图装置,完成下面的填空.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com