
(1)有5种单核粒子,它们分别是 □、
□、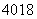 □、
□、 □+、
□+、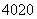 □2+、
□2+、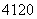 □(“□”内元素符号未写出),则它们所属元素的种类有______种。
□(“□”内元素符号未写出),则它们所属元素的种类有______种。
(2)1H、2H、3H三种微粒都属于________,因为它们是具有相同______________的同一类原子。
(3)在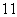 H、
H、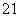 H、
H、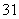 H、
H、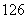 C、
C、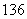 C、
C、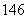 C、
C、 N、
N、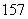 N中,核素、元素的种数分别为______种、______种。
N中,核素、元素的种数分别为______种、______种。
(4)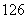 C、
C、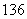 C、
C、 C的关系为__________,因为它们是具有____________________的同一元素的不同原子。其化学性质几乎完全相同。
C的关系为__________,因为它们是具有____________________的同一元素的不同原子。其化学性质几乎完全相同。
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
由下列5种基团中的2个不同基团两两组合,形成的有机物能与NaHCO3溶液反应的有( )
①—OH ②—CH3 ③—COOH ④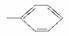 ⑤—CHO
⑤—CHO
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
用晶体的X射线衍射法对Cu的测定得到以下结果:Cu的晶胞为

面心立方最密堆积(如右图),已知该晶体的密度为9.00 g·cm-3,晶胞中该原子的配位数为________;Cu的原子半径为________cm(阿伏加德罗常数为NA,要求列式计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.由于铵盐中是有离子键构成的,因而化学性质相当稳定
B.分子晶体中都存在分子间作用力,但可能不存在共价键
C.在常见的四种晶体类型中,都有“原子(离子)半径越大,物质熔点越低”的规律
D.常温下为气态或液态的物质,其固态时一定会形成分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)氯酸钾熔化,粒子间克服了________的作用力;二氧化硅熔化,粒子间克服了________的作用力;碘的升华,粒子间克服了________的作用力。三种晶体的熔点由高到低的顺序是____________(填化学式)。
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为________(填序号)。
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子是________,由非极性键形成的非极性分子是________,能形成分子晶体的物质是________,含有氢键的晶体的化学式是________________________,属于离子晶体的是____________________,属于原子晶体的是____________________,五种物质的熔点由高到低的顺序是________________。
(4)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:
A.________________;B.________________;
C.________________;D.________________。
(5)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/℃ | 1 266 | 1 534 | 183 |
试解释上表中氟化物熔点差异的原因:_____________________________________。
(6)镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。150 ℃时,Ni(CO)4分解为Ni和CO。Ni(CO)是________晶体,Ni(CO)4易溶于下列________(填序号)
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下图为几种粒子的结构示意图,完成以下填空。
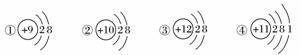
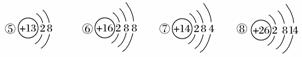
(1)属于阳离子结构的粒子是________(填编号,下同)。
(2)具有稳定性结构的原子是__________________。
(3)只能得电子的粒子是______________;只能失电子的粒子是______________;既能得电子,又能失电子的粒子是____________________________。
(4)③粒子半径________④粒子半径(填“大于”、“小于”或“等于”)。
(5)某元素R形成的氧化物为R2O3,则R的离子结构示意图可能是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)质子数为35、中子数为45的溴原子: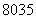 Br( )
Br( )
(2014·江苏,2B)
(2)硫离子的结构示意图: ( )
( )
(2014·江苏,2C)
(3)核外电子排布相同的微粒化学性质也相同( )
(2014·山东理综,8B)
(4)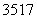 Cl与
Cl与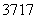 Cl得电子能力相同( )
Cl得电子能力相同( )
(2014·山东理综,8D)
(5)氯原子的结构示意图: ( )
( )
(2013·江苏,2C)
(6)中子数为146、质子数为92的铀(U)原子: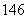 92U( )
92U( )
(2013·江苏,2D)
(7)原子核内有18个中子的氯原子: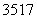 Cl( )
Cl( )
(2012·海南,9D)
(8)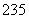 92U和
92U和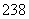 92U是中子数不同质子数相同的同种核素( )
92U是中子数不同质子数相同的同种核素( )
(2012·天津理综,3C)

(9)元素周期表中铋元素的数据见右图,则:
①Bi元素的质量数是209( )
②Bi元素的相对原子质量是209.0( )
(2012·上海,6改编)
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F、G、L、I九种主族元素分别位于三个不同的短周期,它们的原子序数依次增大,其中B、C、D位于同一周期,A与E、B与G、D与L分别位于同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F最外层电子数的2倍,C和D的最外层电子数之和为11。请回答下列问题:
(1)以上元素中非金属所形成的最简单气态氢化物稳定性最弱的是(填化学式)__________________________,E、F、L所形成的简单离子的半径由大到小的顺序为(用离子符号表示)____________。
(2)L、I两元素可按原子个数比1∶1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为__________________________________________。
(3)固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生,写出该反应的离子方程式:_______________________。
(4)由A、B、C、D按原子个数比4∶1∶1∶2形成一种化合物Y,则Y的化学式为________________________,向Y中加足量稀硫酸后,再加高锰酸钾溶液,高锰酸钾溶液褪色。写出使高锰酸钾溶液褪色的反应的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学欲在实验室中对Fe3+与I-的反应进行探究,实现Fe2+与Fe3+的相互转化。
(1)该同学最初的实验操作和现象如下:
| 编号 | 操作 | 现象 |
| Ⅰ | 先向2 mL 0.1 mol·L-1 FeCl2溶液中滴加KSCN溶液,再滴加新制氯水 | |
| Ⅱ | 先向2 mL 0.1 mol·L-1 FeCl3溶液中滴加KSCN溶液,再滴加0.1 mol·L-1 KI溶液 | 滴加KSCN溶液后,溶液变成血红色;滴加KI溶液后,血红色无明显变化 |
①实验Ⅰ的现象为________________________________________________。
②FeCl2溶液与新制氯水反应的离子方程式为____________________________
________________________________________________________________________。
(2)该同学分析了导致实验Ⅱ现象的可能原因,并对实验方案进行了改进。改进后的实验操作和现象如下:
| 编号 | 操作 | 现象 |
| Ⅲ | 向2 mL 0.1 mol·L-1 KI溶液中滴加1 mL | |
| 0.1 mol·L-1 FeCl3溶液,再滴加KSCN溶液 | 滴加FeCl3溶液后,溶液变成黄色;滴加KSCN溶液后,溶液变成血红色 |
根据实验Ⅲ,该同学认为Fe3+有可能与I-发生氧化还原反应,请结合实验现象用简明的文字说明他得出上述结论的理由:_____________________________________________。
(3)该同学认为需要进一步设计实验,证明根据实验Ⅲ中现象得出的结论。请补全下表中的实验方案:
| 编号 | 操作 | 预期现象及结论 |
| Ⅳ | 向2 mL 0.1 mol·L-1 KI溶液中滴加1 mL 0.1 mol·L-1 FeCl3溶液,__________ |
(4)上述实验结果表明,Fe3+有可能与I-发生氧化还原反应。进一步查阅资料知,参加反应的Fe3+与I-的物质的量相同。该同学结合上述实验结论,分析了实验Ⅲ中加入KSCN后溶液变血红的原因,认为Fe3+与I-反应的离子方程式应写为_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com