
 ②S2-
②S2-

分析 (1)铝原子核内质子数为13,核外有3个电子层,第一层上有2个电子,第二层上有8个电子,第三层上有3个电子,硫离子核内质子数为16,核外有3个电子层,第一层上有2个电子,第二层上有8个电子,第三层上有8个电子,据此进行分析解答;
(2)根据微粒的结构示意图,分析微粒的构成,当质子数=核外电子数,为原子;当质子数>核外电子数,为阳离子;当质子数<核外电子数,为阴离子;根据化学元素汉字名称的偏旁可辨别元素的种类;据此进行分析解答.
解答 解:(1)铝原子核内质子数为13,核外有3个电子层,第一层上有2个电子,第二层上有8个电子,第三层上有3个电子,其结构示意图为: ,
,
硫离子核内质子数为16,核外有3个电子层,第一层上有2个电子,第二层上有8个电子,第三层上有8个电子,其结构示意图为: ,
,
故答案为: ;
; ;
;
(2)A.核内质子数是8,核外电子数为8,所以是氧原子,符号是O;
B.核内质子数是8,核外电子数为10,核内质子数比核外电子数小2,所以是氧离子,符号是O2-;
C.核内质子数是16,核外电子数为16,所以是硫原子,符号是S;
D.核内质子数是11,核外电子数为11,所以是钠原子,符号是Na;
①其中属于阴离子的是B,符号是O2-;
故答案为:B;O2-;
②金属元素名称一般有“金”字旁,属于金属元素的是C,钠元素;
故答案为:C.
点评 本题主要考查学生对粒子结构示意图及其意义的理解,明确粒子中核内质子数和核外电子数之间的关系是解题的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 主要原料:碳酸钙 食用方法:每日一次,每次一片,嚼食. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把没用完的药品倒回原试剂瓶中保存 | |
| B. | 配制稀硫酸时,先在量筒内放好水,再缓缓地加入一定量的浓硫酸 | |
| C. | 用天平称量药品质量时,先加质量大的砝码,再加质量小的砝码 | |
| D. | 用排水取气法收集气体时,导管应插入试管底部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 这种饮料不含任何化学物质 | |
| B. | 长期饮用纯水,对身体有益 | |
| C. | 这种“神奇液体”加入水中,可以“以水代油”作为发动机的燃料 | |
| D. | 没有水就没有生命 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第四周期 | B. | 第二周期 | C. | 第ⅣA主族 | D. | 第ⅤA主族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:Na2O2+Na2S+2H2O=S+4NaOH.
.固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:Na2O2+Na2S+2H2O=S+4NaOH. 2SO3(g)△H=-197KJ/mol.
2SO3(g)△H=-197KJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
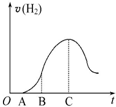 把放在空气中一段时间的5.0g铝片投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,回答下列问题:
把放在空气中一段时间的5.0g铝片投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.8g石墨中的共价键数目 | |
| B. | 250mL1mol•L-1FeCl3溶液中,阴、阳离子总数 | |
| C. | 一定条件下,将1mol SO2和0.5molO2充入一密闭容器内,充分反应后的生成物分子数 | |
| D. | 在反应KClO4+8HCl═KCl+4Cl2↑+4H2O中,生成0.5 molCl2转移的电子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com