
已知某酸H2B在水溶液中存在下列关系:
①H2B H++HB-,②HB-
H++HB-,②HB- H++B2-.关于该酸对应的酸式盐NaHB的溶液,下列说法中,一定正确的是 ( )
H++B2-.关于该酸对应的酸式盐NaHB的溶液,下列说法中,一定正确的是 ( )
A.NaHB属于弱电解质
B.溶液中的离子浓度c(Na+)>c(HB-)>c(H+)>c(OH-)
C.c(Na+)=c(HB-)+c(B2-)+c(H2B)
D.NaHB和NaOH溶液反应的离子方程式为H++OH-===H2O
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
CH3COONa溶液中存在水解平衡:CH3COO-+H2OCH3COOH+OH-,下列说法正确的是 ( )。
A.加入少量NaOH固体,c(CH3COO-)减小
B.加入少量FeCl3固体,c(CH3COO-)减小
C.稀释溶液,溶液的pH增大
D.加入适量的醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+) > c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
SiCl4在室温下为无色液体,易挥发,有强烈的刺激性。把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅。一定条件下,在20L恒容密闭容器中发生SiCl4转化为SiHCl3 的反应:3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g) ΔH=Q kJ·mol-1。2 min后达到平衡,H2与SiHCl3的物质的量浓度分别为0.1 mol·L-1和0.2 mol·L-1。
4SiHCl3(g) ΔH=Q kJ·mol-1。2 min后达到平衡,H2与SiHCl3的物质的量浓度分别为0.1 mol·L-1和0.2 mol·L-1。
(1)从反应开始到平衡,v(SiCl4)= 。
(2)该反应的平衡常数表达式为K= ,温度升高,K值增大,则Q 0(填“>”、“<”或“=”)。
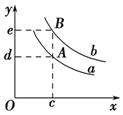 (3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),当反应再次达到平衡时,与原平衡相比较,H2的体积分数将 (填“增大”、“减小”或“不变”)。
(3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),当反应再次达到平衡时,与原平衡相比较,H2的体积分数将 (填“增大”、“减小”或“不变”)。
(4)原容器中,通入H2的体积(标准状况下)为 。
(5)平衡后,将容器的体积缩为10 L,再次达到平衡时,
H2的物质的量浓度范围为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
有关该电池的说法不正确的是 ( )
A.放电时化学能不能全部转化为电能
B.放电时Cd为该电池的负极,充电时这一端应接直流电源的正极
C.放电时该电池的正极反应为:NiOOH+H2O+e-===Ni(OH)2+OH-
D.充电时,阴极反应为:Cd(OH)2+2e-===Cd+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.向0.1 mol/L Na2CO3溶液中滴加酚酞,溶液变红色
B.Al3+、NO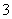 、Cl-、CO
、Cl-、CO 、Na+可大量共存于pH=2的溶液中
、Na+可大量共存于pH=2的溶液中
C.乙醇和乙酸都能溶于水,都是电解质
D.分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36.常温时下列有关说法正确的是 ( )
A.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强
B.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35 mol/L
C.因为H2SO4是强酸,所以反应:CuSO4+H2S===CuS↓+H2SO4不能发生
D.除去工业废水中的Cu2+可以选用FeS作沉淀剂
查看答案和解析>>
科目:高中化学 来源: 题型:
在温度压强不变时,1mol NO2高温分解,生成NO和O2,达到平衡时容器内气体的物质的量变为1.2mol,这时NO2的转化率为( )
|
| A. | 10% | B. | 20% | C. | 40% | D. | 50% |
查看答案和解析>>
科目:高中化学 来源: 题型:
充满HCl的烧瓶做完喷泉实验后得到的稀盐酸,用标准碳酸钠溶液滴定这种盐酸测定它的准确浓度,请你回答下列问题:
(1)用标准Na2CO3溶液滴定这种盐酸时,Na2CO3溶液应装在 式滴定管中,若用甲基橙作指示剂,达到滴定终点时,溶液从 色变为 色.
(2)现配制三种浓度的标准Na2CO3溶液,你认为最合适的是下列第 种.
①2.500mol•L﹣1 ②0.25mol•L﹣1③0.025mol•L﹣1
(3)若采用上述合适浓度的标准Na2CO3溶液滴定,用c(Na2CO3)表示,滴定时实验数据列表如下:
| 实验次数编号 | 待 待测盐酸体积(mL) | 滴入Na2CO3 溶液体积(mL) |
| 1 | 20.00 | 19.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
求这种待测稀盐酸的物质的量浓度(用数据和符号列式即可):c(HCl)= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com