
下列装置合理且能达到实验目的的是
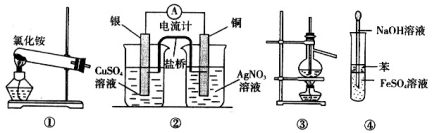
A.实验室用装置①制取氨气
B.装置②将化学能转化为电能
C.装置③可用于分离沸点相差较大的互溶液体混合物
D.装置④可用于 Fe(OH)2 的制取,并能防止 Fe(OH)2 被氧化
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源:2016-2017学年河北省高二上10月月考化学卷(解析版) 题型:选择题
利用催化技术可将汽车尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO 2CO2+ N2。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
2CO2+ N2。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO) /×10-3 mol·L-1 | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
c(CO) / ×10-3 mol·L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |


 下列说法中,不正确的是
下列说法中,不正确的是
 A.2s内的平均反应速率υ(N2)=1.875×10-4 mol·L-1·s-1
A.2s内的平均反应速率υ(N2)=1.875×10-4 mol·L-1·s-1
 B.在该温度下,反应的平衡常数K=5
B.在该温度下,反应的平衡常数K=5
 C.若将容积缩小为原来的一半,NO转化率大于90%
C.若将容积缩小为原来的一半,NO转化率大于90%
 D.使用催化剂可以通过提高活化分子百分数提高单位时间CO和NO的处理量
D.使用催化剂可以通过提高活化分子百分数提高单位时间CO和NO的处理量
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上定时训练(七)化学试卷(解析版) 题型:简答题
用下图中的简易装置可以进行气体的发生和收集。
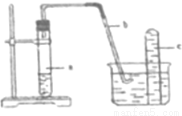
(1)实验前应如何检查该装置的气密性?
(2)拨开试管a的橡皮塞,加入10ml6mol·L-1稀HNO3和1g薄铜片,立即将带有导管的橡皮塞塞紧试管口,反应开始时速度缓慢,逐渐加快,请写出试管a中所发生的所有反应的方程式。
(3)从反应开始到反应结束,预期试管a中可观察到哪些现象?请依次逐一写出。
(4)在反应开始时,可观察到导管b中的水面先沿导管b慢慢上升到一定高度,此后又回落,然后有气泡从管口冒出。试说明反应开始时,导管中水面先上升的原因。
(5)试管c收集满气体后,用拇指堵住管口,取出水槽,将管口向上,松开拇指,片刻后,再次堵住管口,将试管又再倒置于水槽中,松开拇指,此时可观察到什么现象?
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上学期10月月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数值。下列有关叙述正确的是
A.标准状况下,2.24 LCCl4含有的共价键数为0.4NA
B.1 molN2与4 mol H2反应生成的NH3分子数为2NA
C.1 molFe溶于过量硝酸,电子转移数为2NA
D.34g H2O2和H2S混合物中的氢原子数为2NA
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上学期10月阶段测化学卷(解析版) 题型:填空题
酸性 KMnO4 溶液能与草酸(H2C2O4)溶液反应。某化学探究小组利用反应过程中溶液紫色消失快慢的 方法来研究影响反应速率的因素。
I.实验前首先用浓度为 0.1000 mol/L 酸性 KMnO4 标准溶液滴定未知浓度的草酸溶液。
(1)写出滴定过程中发生反应的离子方程式 。
(2)下列有关一定物质的量浓度溶液配制的说法中正确的是 。
A.把 15.8 g KMnO4 固体溶于 1 L 水中所得溶液物质的量浓度为 0.1 mol/L
B.把 0.01 mol KMnO4 固体投入 100 mL 容量瓶中加水至刻度线,充分振荡后,浓度为 0.1 mol/L
C.需要 90 mL 0.1 mol/L 的 KMnO4 溶液,应准确称量 KMnO4 固体 1 58 g
D.定容时仰视容量瓶颈刻度线读数,会使配制的溶液浓度偏高
II.通过滴定实验得到草酸溶液的浓度为 0.2000 mol/L。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为 8.00 mL)。
实验编号 | 温度(℃) | 催化剂用量(g) | 酸性高锰酸钾 溶液 | |
体积(mL) | 浓度(mol/L) | |||
1 | 25 | 0.5 | 4.00 | 0.1000 |
2 | 50 | 0.5 | 4.00 | 0.1000 |
3 | 25 | 0.5 | 4.00 | 0.0100 |
4 | 25 | 0 | 4.00 | 0.1000 |
(3)写出表中实验 1 和实验 2 的实验目的: 。
(4)该小组同学对实验 1 和实验 3 分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
实验 编号 | 溶液褪色所需时间 (min) | ||
第 1 次 | 第 2 次 | 第 3 次 | |
1 | 14.0 | 13.0 | 11.0 |
2 | 6.5 | 6.7 | 6.8 |
分析上述数据后得出“其他条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。甲同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,甲同学改进了实验方案,请简述甲同学改进 的实验方案______________。
(5)该实验中使用的催化剂应选择 MnSO4 并非 MnCl2,原因可用离子方程式表示为________。
III.工业上可用软锰矿(主要成分为 MnO2)经下列生产过程制备高锰酸钾。
①由软锰矿提取得到 MnO2,然后在 MnO2、KOH 的熔融混合物中通入空气可制得锰酸钾(K2MnO4);
②向锰酸钾溶液中通入CO2可获得高锰酸钾。
(6)第①步生产过程中,在熔融混合物中通入空气时发生反应的化学方程式:______________。
(7)向锰酸钾溶液中通入CO2可获得高锰酸钾,该反应中氧化产物与还原产物的物质的量之比为________________。
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上学期10月月考化学试卷(解析版) 题型:实验题
二氧化硫常温下为无色有刺激性气味的有毒气体,易液化,易溶于水。某同学设计如下实验方案,对二氧化硫的化学性质进行探究,装置如下图所示。请回答下列问题:

(1)反应结束时烧瓶中Cu由剩余,某同学认为H2SO4也有剩余,他设计了下列实验方案来测定剩余H2SO4的量。经冷却,定量稀释后进行下列实验,能达到的目的是 (填序号)
a.用酸碱中和滴定法测定
b.与足量Zn反应,测量生成H2的体积
c.用pH计测溶液PH值
d.与足量BaCl2溶液反应,称量生成沉淀的质量
(2)装置B的作用是 ,设计装置C的目的是验证SO2的 性,装置C中发生反应的离子方程式 ,装置D中NaOH全部转化为NaHSO3的标志是____________
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能情况:
I.HSO3-与ClO-刚好反应完; Ⅱ.NaClO不足; Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:(已知酸性:H2SO3>H2CO3>HClO)
实验序号 | 实验操作 | 现象 | 反应的可能情况 |
① | 加入几小块CaCO3固体 | 有气泡产生 | |
② | 滴加少量淀粉KI溶液,振荡 | Ⅲ | |
③ | 滴加少量溴水,振荡 | Ⅱ | |
④ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液为紫色 |
(4)设计简单实验证明:室温下HSO3-的电离平衡常数Ka与水解平衡常数Kb的相对大小 。
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上学期10月月考化学试卷(解析版) 题型:选择题
室温下,A、B两烧杯均盛有10mlpH=2的HA酸溶液,,向B烧杯中加水稀释至pH=3,关于A、B两烧杯中溶液的描述正确的是
A.水电离出的OH-浓度:10c(OH-)A> c(OH-)B
B.溶液的体积:10VA≤ VB
C.若分别用等浓度的氢氧化钠溶液完全中和,所得溶液的pH:A >B
D.若分别与10mLpH=12的氢氧化钠溶液反应,所得溶液的pH:A≤B
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上月考二化学试卷(解析版) 题型:选择题
Na2FeO4是一种离效多功能水处理剂。一种制备Na2FeO4的方法可用化学方程式表示如下:2Fe + 6Na2O2 = 2Na2FeO4 + 2  + O2↑。下列对此反应的说法中,不正确的是
+ O2↑。下列对此反应的说法中,不正确的是
A.方框中的物质为Na2SO4
B.Na2O2既是氧化剂,又是还原剂
C.Na2FeO4既是氧化产物,又是还原产物
D.2molFeSO4发生反应时,反应中共转移8mol电子
查看答案和解析>>
科目:高中化学 来源:2017届河北邯郸市高三上学期第二次月考化学试卷(解析版) 题型:选择题
(NH4)2SO4在一定条件下发生如下反应:4(NH4)2SO4 = N2↑ + 6NH3↑ + 3SO2↑ + SO3↑ + 7H2O,将反应后的混合气体先通过浓硫酸,再通入足量的BaCl2溶液,结果为( )
A.产生BaSO3沉淀 B.产生BaSO4沉淀
C.产生BaSO4和BaSO3沉淀 D.无沉淀产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com