
| A. | 27g铝中加入lmol/L的NaOH溶液,转移电子数是3NA | |
| B. | 原子总数是4NA的N2与CO混合物,其质量是56g | |
| C. | Na2O2和KMnO4分别制得1molO2,转移的电子数均是2NA | |
| D. | 标准状况下,44.8L NO与22.4 L O2反应后的分子数是2NA |
分析 A、NaOH溶液体积未知;
B、氮气和CO均为双原子分子;
C、用过氧化钠制取氧气时,氧元素的价态由-1价变为0价,而用高锰酸钾制取氧气时,氧元素的价态由-2价变为0价;
D、NO和氧气反应后的NO2中存在平衡:2NO2?N2O4.
解答 解:A、NaOH溶液体积未知,故A错误;
B、氮气和CO均为双原子分子,故含4NA个原子的混合物的物质的量为2mol,且两者的摩尔质量均为28g/mol,故质量为56g,故B正确;
C、用过氧化钠制取氧气时,氧元素的价态由-1价变为0价,故用过氧化钠制取1mol氧气时,转移2NA个电子;而用高锰酸钾制取氧气时,氧元素的价态由-2价变为0价,故当制取1mol氧气时转移4NA个电子,故C错误;
D、NO和氧气反应后的NO2中存在平衡:2NO2?N2O4,导致分子个数减少,故分子个数小于2NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意公式的运用和物质的结构特点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 说明AgCl没有完全电离,AgCl是弱电解质 | |
| B. | 说明溶解的AgCl已完全电离,是强电解质 | |
| C. | 说明Ag+与Cl-反应不能完全进行到底 | |
| D. | 说明AgCl(s)与Ag+、Cl-共存,v溶解=v沉淀=0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用菜籽油浸泡花椒制得花椒油的过程未发生化学变化 | |
| B. | 河水中有许多杂质和有害细菌,加入明矾消毒杀菌后可以饮用 | |
| C. | 把浸泡过KMnO4溶液的硅藻土放在水果箱里可延长水果的保鲜期 | |
| D. | 对医疗器械高温消毒时,病毒蛋白质受热变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
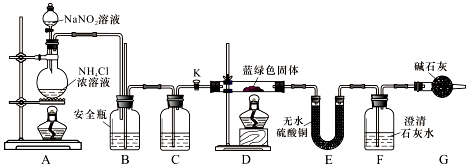
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

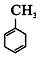 的官能团名称为碳碳双键.
的官能团名称为碳碳双键. 的系统命名为2-丙酮酸,则A的名称是3-丁酮酸.
的系统命名为2-丙酮酸,则A的名称是3-丁酮酸.
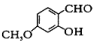 中能与稀NaOH溶液反应的官能团是羟基.检验该官能团的方法是取少量样品,加入氯化铁溶液,如果显紫色,则说明含有酚羟基.
中能与稀NaOH溶液反应的官能团是羟基.检验该官能团的方法是取少量样品,加入氯化铁溶液,如果显紫色,则说明含有酚羟基.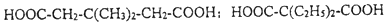 .
.
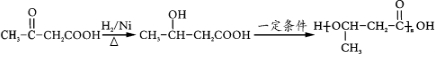 .(无机试剂任用)
.(无机试剂任用)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X被氧化,Y 是氧化剂 | B. | Y被还原,X是氧化剂 | ||
| C. | X是还原剂,Y被氧化 | D. | Y被还原,X2+是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
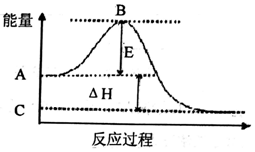
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com