
 我国的铜矿储量居世界第三位,主要集中在江西、云南、甘肃、湖北、安徽、西藏等.铜及其化合物在现代社会中有着极其广泛的应用.
我国的铜矿储量居世界第三位,主要集中在江西、云南、甘肃、湖北、安徽、西藏等.铜及其化合物在现代社会中有着极其广泛的应用.| 1 |
| 8 |


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
A、苯分子的比例模型: |
B、CO2的电子式: |
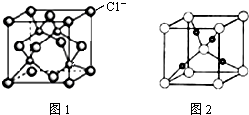
C、Cl-离子的结构示意图: |
| D、乙烯的结构式:CH2=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2溶于水能部分电离,故CO2属于弱电解质 |
| B、溶于水后能电离出氢离子的化合物都是酸 |
| C、硫酸钡难溶于水,但硫酸钡属强电解质 |
| D、强电解质溶液的导电性比弱电解质溶液的导电性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
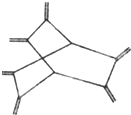
| A、豪猪烯与乙烯互为同系物 |
| B、豪猪烯分子中所有原子在同一平面 |
| C、豪猪烯的分子式为:C14H20 |
| D、豪猪烯能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、向银氨溶液中滴加乙醛:CH3CHO+2[Ag(NH3)2]++H2O
| ||
B、苯酚钠溶液中通入少量CO2: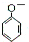 +H2O+CO2→ +H2O+CO2→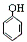 +HCO3- +HCO3- | ||
| C、硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-═NH3?H2O+H2O | ||
| D、氯乙酸与足量的氢氧化钠溶液共热:CH2ClCOOH+OH-→CH2ClCOO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
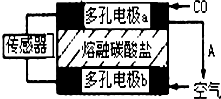 2014年初,雾霾天气多次肆虐我国中东部地区.加强汽车尾气排放监测和降低有毒气体的排放对于减少雾霾具有重要的意义.
2014年初,雾霾天气多次肆虐我国中东部地区.加强汽车尾气排放监测和降低有毒气体的排放对于减少雾霾具有重要的意义.| 催化剂 |
| 浓度 时间/s |
0 | 1 | 2 | 3 | 4 | 5 | 6 |
| c(NO)(×10-4mol/L) | 8.50 | 4.50 | a | 1.50 | 1.00 | 0.80 | 0.80 |
| c(CO)(×10-3mol/L) | 3.60 | 3.20 | 3.00 | b | 2.85 | 2.83 | 2.83 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
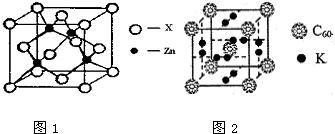 [化学-选修3:物质结构与性质]
[化学-选修3:物质结构与性质]查看答案和解析>>
科目:高中化学 来源: 题型:
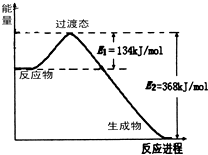 (1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方程式:
(1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方程式:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com