
����Ŀ����300mL���ܱ������У��������۲�����һ������CO���壬һ�������·�����Ӧ��Ni(s) + 4CO(g)![]() Ni(CO)4(g)����֪�÷�Ӧƽ�ⳣ�����¶ȵĹ�ϵ���±���
Ni(CO)4(g)����֪�÷�Ӧƽ�ⳣ�����¶ȵĹ�ϵ���±���
����˵����ȷ���ǣ� ��
�¶�/�� | 25 | 80 | 230 |
ƽ�ⳣ�� | 5��104 | 2 | 1.9��10��5 |
A. ��������Ni(CO)4(g)�ķ�ӦΪ���ȷ�Ӧ
B. 25��ʱ��ӦNi(CO)4(g)![]() Ni(s) + 4CO(g)��ƽ�ⳣ��Ϊ0.5
Ni(s) + 4CO(g)��ƽ�ⳣ��Ϊ0.5
C. ��ij�����´ﵽƽ�⣬���Ni(CO)4��COŨ�Ⱦ�Ϊ0.5mol��L��1�����ʱ�¶ȸ���80��
D. 80��ﵽƽ��ʱ������������䣬����ϵ�г���һ������CO���ٴδﵽƽ���CO�����������С
���𰸡�D
�����������������A����ѧƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬���ݱ������ݣ������¶ȵ����ߣ�ƽ�ⳣ����С���������Ӧ�����Ƿ��ȷ�Ӧ���ʴ���B��Ni(s)��4CO(g)![]() Ni(CO)4(g)����ѧƽ�ⳣ���ı���ʽΪK1=c[Ni(CO)4]/c4(CO)��Ni(CO)4(g)
Ni(CO)4(g)����ѧƽ�ⳣ���ı���ʽΪK1=c[Ni(CO)4]/c4(CO)��Ni(CO)4(g)![]() Ni(s)��4CO(g)����ѧƽ�ⳣ���ı���ʽΪK2=c4(CO)/c[Ni(CO)4] ��K2=1��K��11=1/(5��104)=2��10��5���ʴ���C����ѧƽ�ⳣ��Ϊ0.5/0.54=8������¶�С��80�����ʴ���D���൱������ѹǿ��ƽ��������Ӧ������У��ﵽƽ��CO�����������С������ȷ��
Ni(s)��4CO(g)����ѧƽ�ⳣ���ı���ʽΪK2=c4(CO)/c[Ni(CO)4] ��K2=1��K��11=1/(5��104)=2��10��5���ʴ���C����ѧƽ�ⳣ��Ϊ0.5/0.54=8������¶�С��80�����ʴ���D���൱������ѹǿ��ƽ��������Ӧ������У��ﵽƽ��CO�����������С������ȷ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��þ���Ͻ�Ͷ�뵽20 mL 1 mol/L��HCl��Һ����Ͻ���ȫ�ܽ������Һ�����1 mol/L��NaOH��Һ�����ɳ��������ʵ��������NaOH��Һ���(mL)�仯����ϵ��ͼ��ʾ������˵������ȷ����( )
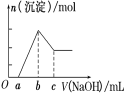
A��þ���Ͻ���к�ǿ�Ŀ���ʴ�����������ܽ����κ��ᡢ�������
B��cֵԽ�Ͻ���Al�ĺ���Խ��
C��bֵԽ�Ͻ���Mg�ĺ���Խ��
D������c��25������ʵ������У�ֻ������4�����ӷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ�����ǰѲ�1molij��ѧ�����յ��������ɸû�ѧ���ļ��ܣ����ܵĴ�С���Թ�����ѧ����ǿ����Ҳ���Թ��ƻ�ѧ��Ӧ�ķ�Ӧ������H������ѧ��Ӧ����H���ڷ�Ӧ�ж��Ѿɻ�ѧ���ļ���֮���뷴Ӧ���γ��»�ѧ���ļ���֮�͵IJ������һЩ��ѧ���ļ��ܣ����ݼ������ݹ������з�Ӧ�ķ�Ӧ�ȣ�CH4��g��+4F2��g��=CF4��g��+4HF��g������HΪ����
![]()
A����1940 kJ/mol
B��+1940 kJ/mol
C����485 kJ/mol
D��+485 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���һ�����0.1 mol��L��1������Һ����μ����Ũ�ȵ�NaOH��Һ����Һ��pOH��pOH����lg[OH��]����pH�ı仯��ϵ��ͼ��ʾ��
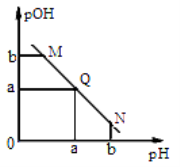
����˵����ȷ������ ��
A��M����ʾ��Һ��������ǿ��Q��
B��N����ʾ��Һ��c(CH3COO��)��c(Na+)
C��M���N����ʾ��Һ��ˮ�ĵ���̶���ͬ
D��Q������NaOH��Һ��������ڴ�����Һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����÷�Ӧ3Cl2��8NH3===N2��6NH4Cl��������ܵ��Ƿ�©��������˵��������ǣ�������
A.���ܵ�©�������ͻ��������
B.�÷�Ӧ������Cl2��ǿ������
C.�÷�Ӧ��NH3����ԭ
D.�÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ե���ʵ�������ȷ���ǣ�������
A.����ˮ��õ�����Һ�ܵ��������
B.����̬�ܵ��������
C.����ʱ���ͨ����ܷ�������
D.��ˮ��Һ�л�����״̬���ܵ���Ļ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ˮ�ĵ���ƽ����������ͼ��ʾ����A���ʾ25 ��ʱˮ�ĵ����ƽ��ʱ������Ũ�ȣ�B���ʾ100 ��ʱˮ�ĵ����ƽ��ʱ������Ũ�ȡ���100 ��ʱ1 mol��L-1��NaOH��Һ�У���ˮ�������c��H+����________mol��L-1��KW��25 ����________KW��100 ����������>������<��������������

��2��25 ��ʱ����ˮ�ĵ���ƽ����ϵ�м�������NH4Cl���壬��ˮ�ĵ���ƽ���Ӱ����________�������ٽ�������������������Ӱ��������
��֪������ݡ�
��ѧʽ | ����ƽ�ⳣ����25 ���� |
HCN | K��4.9��10-10 |
CH3COOH | K��1.8��10-5 |
H2CO3 | K1��4.3��10-7 K2��5.6��10-11 |
��3��25 ��ʱ���е�Ũ�ȵ�NaCN��Һ��Na2CO3��Һ��CH3COONa��Һ��������Һ��pH�ɴ�С��˳��Ϊ____ ___�����ѧʽ��
��4��25 ��ʱ����Ũ�ȵ�CH3COOH��Һ��NaOH��Һ�������ϣ�������Һ�Լ��ԣ���c��Na+��________c��CH3COO-��������>������<��������������
��5����NaCN��Һ��ͨ������CO2����Ӧ�Ļ�ѧ����ʽΪ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ����ú�ˮ�����Ʊ�ʳ�Ρ��������þ�ȹ��ʣ�������ʾ��ͼ���£�
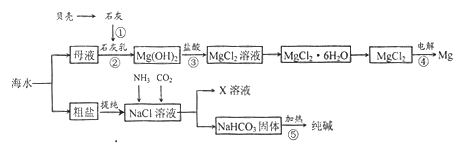
��1����������Ӧ�١����У�û���漰�Ļ�ѧ��Ӧ������______��
A���ֽⷴӦ B�����Ϸ�Ӧ
C�����ֽⷴӦ D���û���Ӧ
��2��д����Ӧ�۵����ӷ���ʽ______________��
��3�������к���Na2SO4��MgCl2��CaCl2�ȿ��������ʣ�Ϊ�Ƶô�����NaCl���壬�������£�
���ܽ⣻
�����μ��������BaCl2��Һ��NaOH��Һ��_____________��
�۹��ˣ�
��______________��
�������ᾧ��
���м�������Ȼ�����Һ��Ŀ����____________________��
��4��X��Һ�е���Ҫ��������Na+��________________��
��5�����鴿����Ʒ���Ƿ�NaClӦѡ�õ��Լ���______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2O5��һ����������������һ���¶��¿ɷ������з�Ӧ��
2N2O5��g��![]() 4NO2��g��+O2��g�� ��H��0 T1�¶��µIJ���ʵ������Ϊ��
4NO2��g��+O2��g�� ��H��0 T1�¶��µIJ���ʵ������Ϊ��
t/s | 0 | 500 | 1 000 | 1 500 |
c��N2O5��/��mol��L-1�� | 5.00 | 3.52 | 2.50 | 2.50 |
����˵������ȷ������ ��
A��500 s��N2O5�ֽ�����Ϊ2.96��10-3mol��L-1��s-1
B��T1�¶��µ�ƽ�ⳣ��ΪK1��125��1 000 sʱת����Ϊ50%
C�������������䣬T2�¶��·�Ӧ��1000sʱ���N2O5��g��Ũ��Ϊ2.98 mol��L-1����T1��T2
D��T1�¶��µ�ƽ�ⳣ��ΪK1��T3�¶��µ�ƽ�ⳣ��ΪK3����K1��K3����T1��T3
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com