
【题目】[2017新课标Ⅱ]丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+![]() O2(g)= C4H8(g)+H2O(g) ΔH2=119 kJ·mol1
O2(g)= C4H8(g)+H2O(g) ΔH2=119 kJ·mol1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3=242 kJ·mol1
O2(g)= H2O(g) ΔH3=242 kJ·mol1
反应①的ΔH1为________kJ·mol1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是_________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
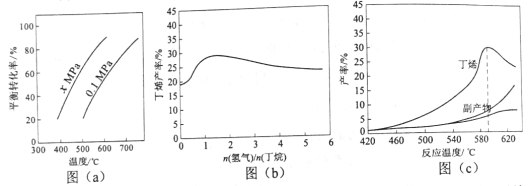
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是__________________________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_________________________________________。
【答案】(1)+123 小于 AD
(2)氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速率增大
(3)升高温度有利于反应向吸热方向进行 温度升高反应速率加快
丁烯高温裂解生成短链烃类
【解析】(1)根据盖斯定律,用②式③式可得①式,因此ΔH1=ΔH2ΔH3=119 kJ/mol +242 kJ/mol =+123 kJ/mol。由图(a)可以看出,温度相同时,由0.1 MPa变化到x MPa,丁烷的转化率增大,即平衡正向移动,根据反应前后气体系数之和增大,减小压强,平衡向正反应方向移动,即x<0.1。提高丁烯的产率,要求平衡向正反应方向移动,A、因为反应①是吸热反应,升高温度,平衡向正反应方向移动,即丁烯转化率增大,故A正确;B、降低温度,平衡向逆反应方向移动,丁烯的转化率降低,故B错误;C、反应前气体系数之和小于反应后气体系数之和,增大压强,平衡向逆反应方向移动,丁烯的转化率降低,故C错误;D、根据C选项分析,降低压强,平衡向正反应方向移动,丁烯转化率提高,故D正确。
(2)因为通入丁烷和氢气,发生①,氢气是生成物,随着n(H2)/n(C4H10)增大,相当于增大氢气的量,反应向逆反应方向进行,逆反应速率增加。
(3)根据图(c),590℃之前,温度升高时反应速率加快,生成的丁烯会更多,同时由于反应①是吸热反应,升高温度平衡正向移动,平衡体系中会含有更多的丁烯。而温度超过590℃时,由于丁烷高温会裂解生成短链烃类,所以参加反应①的丁烷也就相应减少。


科目:高中化学 来源: 题型:
【题目】常温下,若使pH=3的盐酸与pH=9的Ba(0H)2溶液混合使其成为pH=7的溶液,混合时两溶液的体积比为( )。
A.1:60 B.3:1 C.100:l D.1:100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着环境问题的日益严重,垃圾的处理问题正日益被人们所重视.某垃圾处理厂对金属垃圾(主要成分是铁、铜、氧化铁、二氧化硅)处理及综合利用的部分工艺如图所示.请回答下列问题:
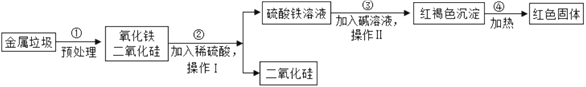
(1)I、II均含有_____操作,此操作中玻璃棒的作用是搅拌、____。操作II完成后红褐色沉淀洗涤的具体操作为_______。
(2)步骤③所发生的反应属于基本反应类型中的______。
(3)请写出步骤②、④所发生反应的化学方程式:
②_____________________________④ ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 钠与水反应:Na+2H2O═Na++2OH﹣+H2↑
B. 电解饱和食盐水获取烧碱和氯气:2Cl﹣+2H2O![]() H2↑+Cl2↑+2OH﹣
H2↑+Cl2↑+2OH﹣
C. 向氢氧化钡溶液中加入稀硫酸:Ba2++OH﹣+H++SO42﹣═BaSO4↓+H2O
D. 碳酸钡和稀硝酸反应:CO32-+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.10 mol·L-1盐酸滴入20.00 mL 0.10mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列说法正确的是
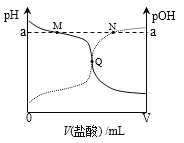
A. M点所示溶液中c(NH4+)+c(NH3·H2O)=c(Cl-)
B. N点所示溶液中溶质一定含NH4Cl,可能还含HCl
C. Q点消耗盐酸的体积等于氨水的体积
D. Q点所示溶液中c(NH4+)> c(Cl-)> c(NH3·H2O)> c(OH-)> c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物在氧气中充分燃烧,生成的水蒸气和CO2的物质的量之比为1∶1,由此可得出结论是( )
A. 该有机物分子中C、H、O个数比为1∶2∶3
B. 分子中碳氢原子个数比为2∶1
C. 有机物中必定含氧
D. 无法判断有机物中是否含有氧元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下1molC3H8发生如下反应:①C3H8→C2H4+CH4②C3H8→C3H6+H2如果C3H8的转化率为80%,且混合气体中m(CH4)=m(H2),则下列说法正确的是( )
A. 反应后混合气体的平均相对分子质量为35.2
B. 两种烯烃物质的量之比,即n(C2H4)/n(C3H6)为1∶1
C. 将混合气体通入溴的四氯化碳溶液,溶液增重128g
D. 两种烯烃物质的量之和,即n(C2H4)+n(C3H6)为0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关NaHCO3和Na2CO3的下列叙述中错误的是( )
①等质量的NaHCO3和Na2CO3分别与足量盐酸反应,Na2CO3产生的CO2多
②84 g NaHCO3、106 g Na2CO3分别与足量的盐酸完全反应,Na2CO3消耗盐酸的物质的量是NaHCO3的两倍
③将澄清石灰水分别倒入两种盐溶液中,只有Na2CO3溶液中产生白色沉淀
④通常状况下,相同温度下,Na2CO3的溶解度大于NaHCO3
A. ①② B. ②③ C. ②④ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是教材中实验装置。

回答下列问题:
(1)甲仪器的名称是______,与同类仪器相比其优点是______、______。
(2)向乙通水,进水口是_______(填“a”或“b”),理由是_____________________。
(3)利用上述装置进行醇与酸的酯化反应。
①醇、酸、酯和水之间的沸点满足的条件是___________。
②如果外接一个装置可以满足蒸馏的条件,那么,此时醇、酸、酯和水之间的沸点满足的条件是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com