
| b |
| 8-a+b |
| 9.6 |
| 32 |
| 4.2 |
| n |


科目:高中化学 来源: 题型:
| A、摩尔是一种表示含有一定数目粒子集合体的物理量 |
| B、漂白粉、水玻璃、聚乙烯、福尔马林均为混合物 |
| C、硅单质常做半导体材料,二氧化硅则是制光导纤维的原料 |
| D、放热反应的化学反应速率不一定比吸热反应的反应速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知X气体是一种无色有刺激性气味的酸性氧化物,有关X、Y、Z、W的转化
已知X气体是一种无色有刺激性气味的酸性氧化物,有关X、Y、Z、W的转化查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| P |
| P0 |
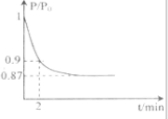
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、测定中和热时,大小两烧杯间填满碎纸的作用是固定小烧杯 |
| B、若用0.010mo1?L-1的氢氧化钠标准溶液滴定未知浓度的盐酸时,滴定前滴定管尖嘴处有气泡,滴定后气泡消失,则测定结果偏小 |
| C、在中和滴定实验中,滴定管用蒸馏水洗涤后,再用标准液润洗,再加进标准液 |
| D、进行中和滴定操作时,左手震荡锥形瓶,右手转动活塞控制液滴流速,眼睛要始终注视滴定管内溶液液面的变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com