
| A. | 氨水中铵根离子和氢氧化钠溶液中钠离子浓度相等 | |
| B. | 温度下降10℃,两溶液的pH均不变 | |
| C. | 氨水和氢氧化钠溶液的浓度相等 | |
| D. | 分别与等浓度的盐酸反应,氨水消耗盐酸的体积与氢氧化钠消耗盐酸的体积相等 |
分析 A.根据电荷守恒分析;
B.弱电解质的电离是吸热反应,降低温度抑制NH3.H2O电离;
C.向氨水中加入NH4Cl晶体抑制NH3.H2O电离,向NaOH溶液中加入NH4Cl生成NH3.H2O;
D.pH相等的氨水和NaOH溶液,氨水浓度大于NaOH,等pH、等体积的氨水和NaOH,氨水的物质的量大于NaOH,分别和同浓度的稀HCl反应时,消耗HCl的体积与碱的物质的量成正比.
解答 解:A.相同温度、相同pH和相同体积的氨水、氢氧化钠溶液,溶液中电荷守恒为:c(NH4+)+c(H+)=c(OH-),c(Na+)+c(H+)=c(OH-),由于两种溶液中氢离子浓度相同,所以c(NH4+)=c(Na+),故A正确;
B.NH3.H2O电离吸收热量,降低温度,抑制NH3.H2O电离,所以降低温度后氨水pH降低,故B错误;
C.NH3.H2O是弱电解质,在溶液中部分电离,所以氨水中NH3.H2O 的浓度大于氢氧根离子的浓度,氢氧化钠中NaOH的浓度等于氢氧根离子浓度,所以氨水的浓度大于氢氧化钠溶液的浓度,故C错误;
D.pH相等的氨水和NaOH溶液中,c(NH3.H2O)>c(NaOH),等pH、等体积的氨水和NaOH,n(NH3.H2O)>n(NaOH),分别和同浓度的稀HCl反应时,消耗HCl的体积与碱的物质的量成正比,所以氨水消耗稀盐酸的体积大于NaOH,故D错误;
故选A.
点评 本题考查了弱电解质的电离,明确弱电解质在水溶液中存在电离平衡即可解答,注意加水稀释或改变温度都改变氨水pH,但加水稀释不改变一水合氨电离平衡常数,题目难度不大.


科目:高中化学 来源: 题型:解答题
 如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol•L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④量筒.
如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol•L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④量筒.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3COOH为常见的弱酸,在工业生产和生活中有广泛的应用.
CH3COOH为常见的弱酸,在工业生产和生活中有广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水 ②0.1 mol/L盐酸③0.1 mol/L氯化镁溶液 ④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ | |
| B. | 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 | |
| C. | 向Mg(OH)2悬浊液中滴加FeCl3溶液,沉淀变为红褐色,说明溶解度Mg(OH)2>Fe(OH)3 | |
| D. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
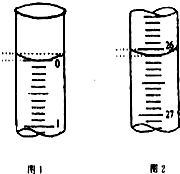 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
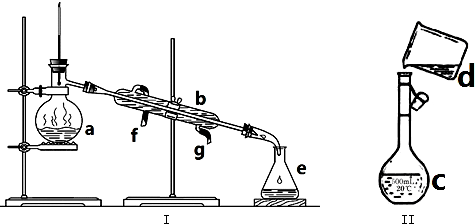
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 次数 | 测量项目 | 测量数据(mg/mL) |
| 1 | 铜离子含量 | 4.224 |
| 2 | 4.225 | |
| 3 | 4.223 | |
| 4 | 2.005 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
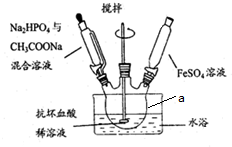
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用H++OH-═H2O來测量某氢氧化钠溶液的浓度时:甲基橙--橙色 | |
| B. | 利用“2Fe3++2I-═I2+2Fe2+,用NaI溶液测量Fe(NO3)3样品中Fe(NO3)3百分含量:淀粉--蓝色 | |
| C. | 利用“Ag++SCN-=AgSCN↓原理,可用标准KSCN溶液含量AgNO3溶液浓度:Fe(NO3)3--血 红色 | |
| D. | 用标准酸性KMnO4溶液滴定NaHSO3溶液以测量其浓度:KMnO4--紫红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com