
用数轴表示化学知识,并按某种共性对化学物质进行分类,有简明易记的效果.例如,根据碳素钢的含碳量,将其分为低碳钢、中碳钢和高碳钢,利用数轴的分类法可将其表示为
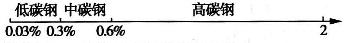
根据这一分类法回答下列问题:
(1)将pH与溶液酸碱性的关系粗略地表示在如下数轴上(常温下):
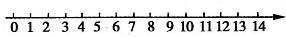
(2)某化学兴趣小组欲研究H2SO4、KCl、Na2SO3、Na2CO3、NaCl、NaOH的性质,对于如何研究,他们设计了两种方案:
方案Ⅰ:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验.
方案Ⅱ:将它们按照钠盐、钾盐和其他化合物分类,然后分别溶于水得到溶液,边行实验.
①根据方案Ⅰ进行分类时,经实验测得KCl、NaCl溶液的pH等于7;H2SO4溶液的pH小于7;Na2SO3、Na2CO3、NaOH溶液的pH大于7.由此有的同学按分类法思想把Na2SO3、Na2CO3与NaOH都划分为碱类,这样划分是否合理?为什么?
②在方案Ⅰ中,某同学发现盐类物质中的KCl和NaCl两种物质,它们在与其他物质混合时现象相同,无法区分,请你设计一种简单的方法区分这两种物质: .
③在方案Ⅱ中,三种钠盐用其他化合物中的H2SO4可加以区分,有关反应的化学方程式分别为 .
④该兴趣小组中的一位同学认为,还可以根据是否含有钠元素将上述六种物质分为Na2SO3、Na2CO3、NaCl、NaOH和H2SO4、KCl两类.在用H2SO4鉴别四种含钠元素的物质时,Na2SO3和Na2CO3,很容易区分,但鉴别NaCl和NaOH时却陷入了困境,请你帮忙解决这一难题(试剂只限于上述六种物质): ;.
考点: 性质实验方案的设计.
专题: 实验设计题.
分析: (1)根据溶液酸碱性数值的范围分析:酸性溶液,PH<7;中性溶液,PH=7;碱性溶液,PH>7;
(2)①Na2SO3、Na2CO3、溶液呈碱性的原因是弱酸阴离子水解,NaOH溶液呈碱性,是因为氢氧化钠是强碱溶液;
②氯化钠、氯化钾溶液中的钠离子和钾离子检验利用焰色反应进行;
③三种钠盐Na2SO3、Na2CO3、NaCl,依据阴离子性质和鉴别方法分析回答;
④依据氯化钠和氢氧化钠的性质,氯化钠和其他物质的溶液不反应,氢氧化钠和硫酸反应但无明显的现象,所以可以利用碳酸钠和酸生成气体设计检验方法,先加硫酸,再加碳酸钠观察是否有气体生成.
解答: 解:(1)已知溶液酸碱度的取值范围,中点为7,小于7呈酸性,大于7呈碱性,故答案为:
PH<7酸性 PH=7中性 PH>7碱性
(2)①划分不合理,Na2SO3、Na2CO3、溶液呈碱性的原因是弱酸阴离子水解,NaOH溶液呈碱性,是因为氢氧化钠是强碱溶液;
故答案为:不合理,显碱性的原因不同,Na2SO3、Na2CO3、溶液呈碱性的原因是弱酸阴离子水解,NaOH溶液呈碱性,是因为氢氧化钠是强碱溶液;
②KCl和NaCl两种物质利用钠离子和钾离子的焰色反应检验,隔着钴玻璃呈紫色的为氯化钾,焰色反应呈黄色的为氯化钠;
故答案为:焰色反应透过钴玻璃呈紫色说明是氯化钾,焰色反应呈黄色为氯化钠;
③三种钠盐Na2SO3、Na2CO3、NaCl,可以和硫酸反应鉴别,亚硫酸钠与硫酸反应生成硫酸钠、无色有刺激性气味的气体二氧化硫和水,碳酸钠和硫酸反应生成硫酸钠、无色无味的气体二氧化碳和水,氯化钠不与硫酸反应,反应的化学方程式为:H2SO4+Na2CO3=Na2SO4+CO2↑+H2O H2SO4+Na2SO3=Na2SO4+SO2↑+H2O;
故答案为:H2SO4;H2SO4+Na2CO3=Na2SO4+CO2↑+H2O H2SO4+Na2SO3=Na2SO4+SO2↑+H2O;
④鉴别NaCl和NaOH时,在两支试管中分别加入少许硫酸溶液,分别加入稍过量的两种未知溶液,充分混合,再向混合液中分别滴入碳酸钠溶液,若有气泡生成,说明含有硫酸,则加入的未知液为NaCl,若无气泡生成,说明硫酸反应完,不和碳酸钠反应生成气体,则加入的未知液为NaOH溶液;
故答案为:在两支试管中分别加入少许硫酸溶液,分别加入稍过量的两种未知溶液,充分混合,再向混合液中分别滴入碳酸钠溶液,若有气泡生成,则加入的未知液为NaCl,若无气泡生成,则加入的未知液为NaOH溶液.
点评: 本题考查物质性质的验证方法和实验设计方案,物质性质的应用,离子反应的现象分析判断是解题关键,注意④步骤实验设计的步骤,题目难度中等.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
一定能在下列溶液中大量共存的离子组是()
①含有大量Al3+的溶液中:Na+、NH4+、SO42﹣、Cl﹣
②加入Al能放出H2的溶液中:Cl﹣、HCO3﹣、SO42﹣、NH4+
③含有大量Fe3+的溶液中:Na+、Mg2+、NO3﹣、SCN﹣
④在含有大量AlO2﹣的溶液中:NH4+、Na+、Cl﹣、H+
⑤由水电离出的c(H+)=1×10﹣14mol•L﹣1的溶液中:Ca2+、K+、Cl﹣、HCO3﹣.
A. ①② B. ①③⑤ C. ① D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
1.52g 铜镁合金完全溶解于50mL 密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是( )
A. 该合金中铜与镁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C. NO2和N2O4的混合气体中,NO2的体积分数是80%
D. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
用18mol/L H2SO4配制90mL 1.0mol/L H2SO4,
若实验仪器有A.100m L 量筒 B.托盘天平 C.玻璃棒 D.50m L容量瓶 E.10m L量筒 F.胶头滴管 G.50m L烧杯 H.100m L 容量瓶 G.5ml量筒
(Ⅰ)实验时选用的仪器有(填序号) .
配制过程中,下列情况会使配制结果偏高的是(填序号) .
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度
(Ⅱ)在容量瓶使用方法中,下列操作不正确的是(填序号)
A.使用容量瓶前检查它是否漏水.
B.容量瓶用蒸馏水洗净后,再用待配液润洗.
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2cm处,再改用胶头滴管加蒸馏水到刻度线.
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近刻度线线1~2cm处,再改用胶头滴管加蒸馏水到刻度线.
E.定容后,盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转、摇匀.
F.如配制100mL0.200mol/L的氯化钠溶液时,可将称量的氯化钠固体溶于100mL蒸馏水中.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 可用丁达尔现象区分葡萄糖溶液和淀粉胶体
B. 生石灰与水混合的过程只发生物理变化
C. O3是由3个氧原子构成的化合物
D. CuSO4•5H2O是一种混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
已知人体体液中存在如下平衡:H++ HC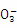
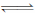 H2CO3
H2CO3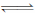 CO2+H2O,以维持体液的pH的相对稳定。下列说法中不合理的是
CO2+H2O,以维持体液的pH的相对稳定。下列说法中不合理的是
A.当强酸性物质进入体液后,上述平衡向右移动,以维持体液的pH的相对稳定
B.当强碱性物质进入体液后,上述平衡向左移动,以维持体液的pH的相对稳定
C.若静脉滴注大量生理盐水,则体液的pH减小
D.进行呼吸活动时,如CO2进入血液,会使体液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化剂作用下,通过下列反应:CCl4+H2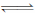 CHCl3 + HCl使CCl4转化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4 等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。
CHCl3 + HCl使CCl4转化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4 等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。
(1)在密闭容器中,该反应达到平衡状态后,测得如下数据(假设不考虑副反应)。
| 实验序号 | 温度 /℃ | 初始CCl4的浓度 /(mol • L﹣1) | 初始H2的浓度/(mol • L﹣1) | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | B |
①此反应的化学平衡常数表达式为___________,在110℃时平衡常数为_____________。
②实验1中,CCl4的转化率A____________50%(填”大于”“小于”或”等于”)。
③实验2中,10 h后达到平衡,H2的平均反应速率为________________。
④实验3中,B的值____________(填序号)。
A.等于50% B.大于50%
C.小于50% D.从本题资料无法判断
(2)120℃时,在相同条件的密闭容器中,分别进行H2 的初始浓度为2 mol • L﹣1和4 mol • L﹣1的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线)。
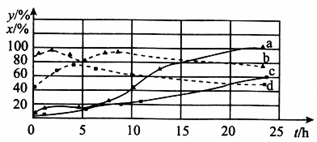
①在图中的四条线中,表示H2的起始浓度为2mol • L﹣1的实验消耗CCl4的百分率变化曲线是___________(填序号)。
②根据上图曲线,氢气的起始浓度为___________mol • L﹣1时,有利于提高CCl4的平衡转化率和产物中CHCl3的百分含量。你判断的依据是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质不能使酸性KMnO4溶液褪色的是( )
①乙烯; ②乙烷; ③乙苯; ④乙炔; ⑤二氧化硫; ⑥二甲苯.
A. ②③⑥ B. ③⑥ C. ②③⑤⑥ D. ②
查看答案和解析>>
科目:高中化学 来源: 题型:
分类是学习和研究化学的一种重要方法,下列分类合理的是( )
|
| A. | K2CO3和K2O都属于盐 |
|
| B. | Na2O和Na2SiO3都属于氧化物 |
|
| C. | KOH和Na2CO3都属于碱 |
|
| D. | H2SO4和HNO3都属于酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com