
(12分)含铬化合物有毒,对人畜危害很大。因此含铬废水必须进行处理才能排放。
已知: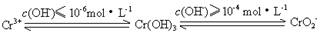
(1)在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去。
①写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式 。
②用离子方程式表示溶液pH不能超过10的原因 。
(2)将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合成氢氧化物沉淀而除去。
①写出阴极的电极反应式 。
②电解法中加入氯化钠的作用是 。
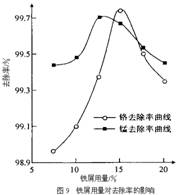
(3)某化学兴趣小组以含+6价铬和+2价锰的工业废水为试样,研究铁屑用量和pH值对废水中铬、锰去除率的影响。
①取100mL废水于250 mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如下图9所示。则在pH一定时,废水中铁屑用量为 时,锰、铬去除率最好。
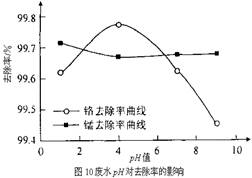
②取100mL废水于250 mL三角瓶中,加入规定量的铁粉,调成不同的pH值。得到pH值对铬和锰去除率的影响如下图10所示。则在铁屑用量一定时,废水pH= 时锰、铬去除率最好。
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
 含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.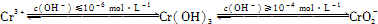
2- 7 |
2- 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)含铬化合物有毒,对人畜危害很大。因此含铬废水必须进行处理才能排放。
已知:
(1)在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去。
①写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式 。
②用离子方程式表示溶液pH不能超过10的原因 。
(2)将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合成氢氧化物沉淀而除去。
①写出阴极的电极反应式 。
②电解法中加入氯化钠的作用是 。
(3)某化学兴趣小组以含+6价铬和+2价锰的工业废水为试样,研究铁屑用量和pH值对废水中铬、锰去除率的影响。
①取100mL废水于250 mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如下图9所示。则在pH一定时,废水中铁屑用量为 时,锰、铬去除率最好。
②取100mL废水于250 mL三角瓶中,加入规定量的铁粉,调成不同的pH值。得到pH值对铬和锰去除率的影响如下图10所示。则在铁屑用量一定时,废水pH= 时锰、铬去除率最好。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年甘肃河西五市高三第一次联合考试化学试卷(解析版) 题型:填空题
环境污染中除了有害气体产生的空气污染外,重金属离子在溶液中引起的水体污染也相当严重.近年来城市汽车拥有量呈较快增长趋势,汽车尾气的主要有害成分一氧化碳和氮氧化物加重了城市空气污染.研究NO2、SO2、CO等大气污染气体的处理及研究重金属离子水污染的处理具有非常重要的意义.
(1)一定条件下,NO2与SO2反应生成SO3和NO两种气体.将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,若测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=?????? .
(2)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例).
已知:NO不能与Na2CO3溶液反应.
NO+NO2+Na2CO3=2NaNO2+CO2;2NO2+Na2CO3=NaNO2+NaNO3+CO2
用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则混合气体中NO和NO2的体积比为??????????? .
(3)如图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质.A为电池的?????? 极(选填“正”或“负”).写出B极电极反应式?????????????????????????? .

 (4)含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
(4)含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
已知:
在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去.用离子方程式表示溶液pH不能超过10的原因????????????????????????????? .
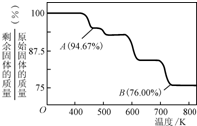
(5)铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中.
CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示.则B点时剩余固体的成分是????????????? (填化学式).

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com