
| ���� | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
���� �ټ״�ȼ�ϵ�ؼ״��ڸ���ʧ���ӣ�����Һ������̼���Σ�������Һ��������������ƽ����غ㣻
�ڸ���ԭ���ԭ��������O2�õ��������ɸ���O2-�����ݵ��ԭ������Һ�����ӷŵ�˳��ϵ����غ�͵缫��Ӧ����õ���
��� �⣺��ȼ�ϵ�أ���ص�һ���缫ͨ ���������һ���缫ͨ��״����壬�����������������Һ������ԭ���ԭ���������缫��Ӧ��O2�õ�������������������-��O2+2H2O+4e-=4OH-�������缫��Ӧ��CH3OH-6e-+8OH-=CO32-+6H2O��
�ʴ�Ϊ��CH3OH-6e-+8OH-=CO32-+6H2O��
��ȼ�ϵ�أ���ص�һ���缫ͨ���������һ���缫ͨ��״����壬�����������������Һ������ԭ���ԭ���������缫��Ӧ��O2�õ������������������ӣ�O2+2H2O+4e-=4OH-�������缫��Ӧ��CH3OH-6e-+8OH-=CO32-+6H2O�����һ��ʱ��������ռ�����ͬ��������������������ʱ��������Һ����ı仯���缫������ܴ��ڵ��ܽ��������ݵ缫��Ӧ��
�����缫��ӦΪ��2Cl--2e-=Cl2����4OH--4e-=2H2O+O2����
0.4mol 0.4mol 0.2mol 4x x
�����缫��ӦΪ��Cu2++2e-=Cu��
0.1mol 0.2mol 0.1mol
2H++2e-=H2���� 2H++2e-=H2����
0.4mol 0.4mol 0.2mol 2x x
���ݵ����غ�0.4+4x=0.2+0.4+2x��x=0.1mol���������ռ������������ʵ���0.1mol�����������Ϸ����ķ�Ӧ��2Cl--2e-=Cl2����4OH--4e-=2H2O+O2����
�ʴ�Ϊ��2Cl--2e-=Cl2����4OH--4e-=2H2O+O2����
���� ���⿼��ԭ��غ͵��صĹ���ԭ���Լ��缫��Ӧ����д�ͼ���֪ʶ�����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH3CH2CH3��CH4��Ϊͬϵ�� | |
| B�� | �Ҵ������ᶼ��������Ʒ�Ӧ | |
| C�� | �����飨CH3CH2CH2CH3�����춡�飨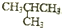 ����Ϊͬ���칹�� ����Ϊͬ���칹�� | |
| D�� | �����뱽�ڿ�����ȼ�յ�������ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | CH3OH | CH3OCH3 | H2O |
| Ũ��/��mol•L-1�� | 0.44 | 0.6 | 0.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ĭ����� | B�� | �ɷ������ | C�� | ˮ | D�� | ϸɳ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ù�����ˮ���չ�ҵβ���е�SO2��NH3•H2O+SO2�TNH4++SO32-+H2O | |
| B�� | MnO2��Ũ���ᷴӦ��Cl2��MnO2+4HCl$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++2Cl-+Cl2��+2H2O | |
| C�� | ��FeBr2��Һ��ͨ������������2Fe2++4Br-+3Cl2�T2Fe3++2Br2+6Cl- | |
| D�� | �����ȥˮ����2H++CaCO3�TCa2++CO2��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
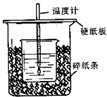 ��50mL 0.50mol/L������50mL 0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ���֪��������4.18J/��g���棩���ش��������⣺
��50mL 0.50mol/L������50mL 0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ���֪��������4.18J/��g���棩���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaCl��AgNO3 | B�� | Na2CO3��ϡ���� | C�� | Al2��SO4��3��NaOH | D�� | �����Na[Al��OH��4] |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
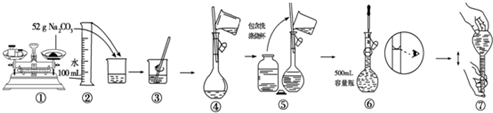
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com